[팜뉴스=김민건 기자] 7일 한국머크 바이오파마(대표 크리스토프 하만)는 MET 엑손 14 결손 변이 비소세포폐암 치료제 텝메코(테포티닙)의 'VISION 연구' 장기 추적 결과가 지난 4일(현지시각) 미국임상종양학회(American Society of Clinical Oncology, ASCO) 연례학술회의에서 발표됐다고 밝혔다.
텝메코는 MET 엑손 14 결손 변이(이하 MET 변이)가 확인된 국소 진행성 또는 전이성 비소세포폐암 치료제로, 1일 1회 경구 복용이 가능한 MET 억제제이다.
MET 변이는 전체 비소세포폐암 환자의 2~4%에서 나타나는 공격적인 특징을 가지고 있어 다른 항암 치료에서 내성을 일으키고, 뼈, 뇌 등으로의 전이로 이어질 수 있다. MET 변이 비소세포폐암 환자의 88%는 한 군데 이상의 전이를 가지고 있으며, 4기 환자의 전체생존기간 중앙값은 6.7개월에 불과할 정도로 예후가 좋지 않다.
VISON연구(Cohort A+C)는 6700명 이상의 환자를 스크리닝해 313명이 등록된 최대 규모의 MET 변이 임상 연구다. 임상을 통해 액체 생검 또는 조직 생검으로 진단된 MET 변이 국소 진행성 또는 전이성 비소세포폐암 환자에서 텝메코의 효과를 확인했다. 또한 동양인(전체 환자군 중 33.9%)을 대상으로 한 하위군 분석에서도 일관된 효과를 입증했다.
이날 새롭게 발표된 연구는 VISION 연구의 장기 추적 결과로, 텝메코는 32.6개월(추적관찰기간 중앙값: 0.3-71.9, 데이터 컷오프: 2022년 11월 20일) 동안 치료 차수와 관계없이 유의미한 생존 연장 효과와 관리 가능한 수준의 안전성을 확인했다.
해당 연구는 313명의 MET 변이가 있는 진행성 혹은 전이성 비소세포폐암 성인 환자를 대상으로 진행됐다. 참여한 환자의 연령 중앙값은 72세(41-94)로 고령이었으며, 환자의 47.6%는 흡연 이력을 갖고 있었다.
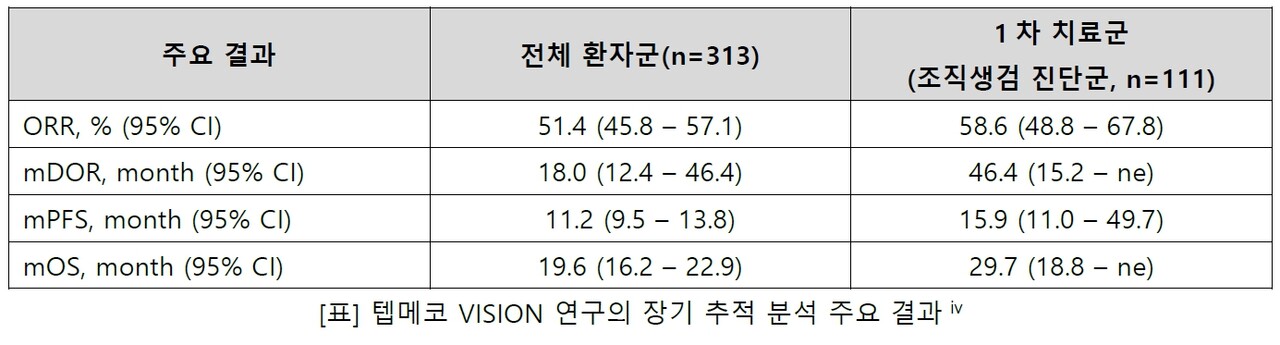
장기 추적 결과, 전체 환자군(313명)의 객관적반응률 51.4%(45.8~57.1), 반응지속기간 중앙값 18.0개월(12.4~46.4), 무진행생존기간 중앙값 11.2개월(9.5~13.8), 전체생존기간 중앙값 19.6개월(16.2-~22.9)로 나타났다.
특히 조직생검으로 진단받은 1차 치료 군(111명)의 객관적반응률은 58.6%(48.8~67.8), 반응지속기간 중앙값은 46.4개월(15.2-ne)로 전체 환자군보다 높았다. 또한 해당 환자군에서 전체생존기간 중앙값 29.7개월(18.8 – ne), 무진행생존기간 중앙값 15.9개월(11.0-49.7)을 보이며, 1차 투여 시에 더 효과적임을 입증했다.
가장 흔하게 나타난 이상 반응은 말초 부종이었으며 3단계 이상의 부작용을 경험한 환자는 전체의 11.2%로, 새로운 안전성 관련 정보는 파악되지 않았다. 해당 연구는 장기 추적 분석 결과가 발표된 날, 미국의사협회저널(The Journal of American Medical Association, JAMA)에도 게재됐다.

이와 같은 결과는 지난 2022년 발표된 VISION 연구 결과와 일관됐다. 313명의 MET 변이 비소세포폐암 환자가 참여한 VISION A+C 연구에서 조직 생검을 통해 진단받은 208명의 환자를 분석한 결과, 1차 치료(111명)에서 객관적반응률은 56.8%, 무진행생존기간 중앙값은 15.3개월, 전체생존기간 중앙값은 25.9개월을 보였으며, 치료 경험이 있는 환자군(2차 치료 이상)에서도 객관적반응률 49.5%, 무진행생존기간 중앙값 11.5개월, 전체생존기간 중앙값 20.4개월을 확인했다.
텝메코 효과와 안전성은 동양인에게서도 확인됐다. 한국인을 포함한 동양인 106명을 대상으로 한 하위그룹 분석에서 텝메코의 객관적반응률은 57.5%, 반응지속기간은 18.5개월, 무진행생존기간 중앙값 13.8개월, 전체생존기간 중앙값 23.7개월을 보였으며, 특히 치료 경험이 없는 환자에서66.0%의 객관적반응률을 확인했다.
한국머크 바이오파마 항암제사업부 이수경 총괄은 "MET 엑손 14 결손 변이 비소세포폐암의 생존 기간이 1년 미만으로 변이가 없는 비소세포폐암 환자의 1/5에 불과하고 , 기존의 항암화학요법이나 면역항암제 만으로는 치료 효과가 충분하지 않았다"고 말했다.
이 총괄은 "이번 연구는 텝메코의 장기 생존 효과와 안전성을 보여줌으로써 MET 변이 비소세포폐암의 새로운 치료 패러다임을 제시했다는 점에서 굉장히 큰 의미가 있다"고 말했다.
한편, 텝메코는 1일 1회 복용하는 선택적이고 강력한 Ib형 MET 억제제다. 지난 2020년 MET 변이 치료제 중 전세계 최초로 일본에서 혁신의약품에 대한 신속허가 트랙인 사키가케 패스트 트랙을 통해 허가됐다.
뒤이은 2021년 MET 변이가 있는 전이성 비소세포폐암 성인 환자의 치료제로 FDA 허가 를 획득하고, 2022년 10월 국내 출시됐다. 현재 A8 국가 중 6개 국가(미국∙영국∙일본∙스위스∙독일∙이탈리아)에 급여 등재됐으며, 호주∙영국∙스코틀랜드 등 의료기술평가(HTA) 국가에서 1차 치료 이상에 급여 권고되고 있다.
키워드
#텝메코관련기사
- [기자의 펜] 알 수 없는 유전변이 표적치료제 급여기준 설정
- [명약만리] 텝메코, 최대 규모 글로벌 임상으로 MET 변이 표적치료 시대 열다
- MET 표적치료 타브렉타 비급여 출시 가닥, 암질심 '3상 수준' 무리한 요구였나
- "타브렉타·텝메코는 다음에" 암질심 미끄러진 MET변이 표적치료제
- MET 표적치료제 텝메코, 아시안인 환자에서 효과 어땠나
- MET변이 표적치료제 신약 '텝메코'를 보는 3가지 포인트
- '독하다 독해, 이래도 안써?' 텝메코, MET변이 한국인 데이터 또 발표
- "한국은 글로벌 제약산업에 매력적, 신약 출시 우선 고려하는 시장"
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

