해외실사 시 언어문제 해결 및 외양조건 중요
한미 FTA 타결과 더불어 우리 제약산업의 GMP(Good Manufacturing Practice)를 미국의 cGMP 수준으로 향상시켜야 한다는 요구가 높아지고 있으며 식품의약품안전청도 오는 2010년부터 밸리데이션 의무화를 비롯 품목별 GMP를 전면 실시키로 한 상태이다. 하지만 우리가 목표로 삼는 cGMP(current GMP)는 고정된 실체가 아닌 계속 변화되는 제약환경에 따라 업그레이드 돼야 하는 대상이다.
미국에서 GMP는 1970년대 이후 거의 변화가 없지만 컴퓨터화 및 자동화가 가속화됨에 따라 위험 평가(risk assessment)가 주요기준이 되고 있다. 더욱이 글로벌 사업 제휴와 복잡한 제품 기술활용이 증가하면서 FDA가 제품 및 공정 품질에 더욱 중점을 두고 있다는 것. 제조업체 및 규제 전문가들은 cGMP 실사와 실행에 있어 큰 변화가 올 것으로 전망하고 있다.
하지만 산업계와 규제 전문가들은 FDA 실사에 변화가 와도 준비하는 동안 유의해야 할 기본 요인들이 있다고 입을 모은다. 미국의 변화하는 규제 환경에서 FDA의 GMP 실사를 준비하는 방법을 소개한다.
FDA ORA(Office of Regulatory Affairs)의 현장조사 부문 마이클 로저 소장에 따르면, 조사기간 동안 FDA는 제조과정을 통한 원료 입수 및 실험실 테스트 관련 부분부터 제조단계에서 회사에 요구되거나 스스로 부여하는 모든 것들에 이르기까지 전부를 검토할 수 있다.
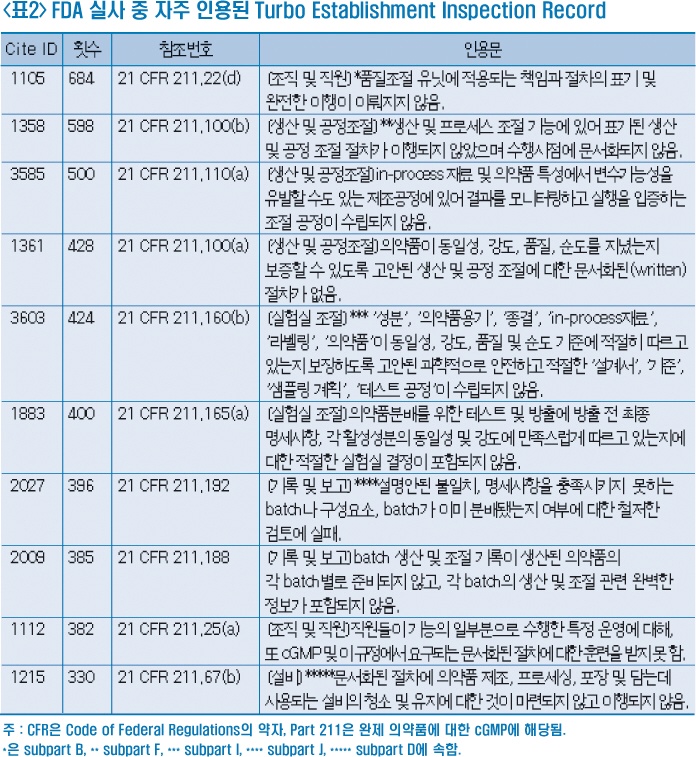
cGMP를 잘 준수하는 데 모두에게 단번에 통하는 전략은 없지만 오랜 기간에 걸쳐 제조업체들에게 만연된 일부 문제들은 있다. FDA에 지적된 사항들을 살펴보면 품질조절, 명세사항에 벗어난 결과, 공정 밸리데이션, 무균성(sterility), 오염 등과 관련된 것들이 가장 큰 문제로 지적되고 있다.

승인전 실사는 항상 그런 것은 아니지만 대부분 며칠 전에 발표된다. 승인 후 실사 혹은 GMP 실사는 사전 고지 없이 이뤄질 수도 있다. 누가 실사를 맡는가는 회사 규모, 실사 대상 제품 수 및 복잡성, 실사 전력(history) 등에 따라 달라진다.
실사팀은 조사자들, 분석가들, 기술자들 및(혹은) 컴퓨터 전문가들로 구성될 수 있지만 대부분의 경우 검토 대상 제품에 따라 화학자 혹은 미생물학자 한 명을 포함한 두 명의 조사자가 오게 된다.
FDA 조사는 어디에서든 하루에서 2개월간 지속되며 단일제품 당 평균 약 1주로 볼 수 있다. 이전에 있던 컴플라이언스(compliance) 문제, 불만 혹은 리콜로 인해 조사 기간이 연장될 수도 있다.
철저한 위기평가 필수
GMP에 있어 대부분 1970년대 이후로 큰 변화가 없지만 지금까지 증가한 컴퓨터화 및 자동화에 따라 위험 평가에 시스템에 기반 한 접근법을 취하게 됐다.
Weinberg Group의 컴플라이언스 및 품질 관리 부사장인 John C. Garvey는 GMP에 큰 변화가 없는 것으로 보이는 이유 중 하나로서 조사관들이 시스템 기반 기술을 사용할 때에도 제품 실패, 일탈(deviation) 및 제품 불만 등을 살펴보는 네가티브한 제품 경험을 통해 정보를 수집하는 전통적 수단에 의존하기 때문이라고 지적했다.
하지만 前FDA 조사관으로서 200건 이상의 실사를 실시한 바 있는 Carmen Medina에 따르면, 20년 전만 해도 조사관들은 개별 서류에서 부적합 및 제조 일탈, 이들 결점이 현장에서 제품에 미치는 영향을 주시한 반면 현재는 전체 운영 내에서 잠재적으로 모든 하나하나 제품에 영향을 미칠 수 있는 기업의 위험수준을 살핀다는 것. 즉 요즘 조사관들은 top-down 평가를 수행하도록 훈련되고 있다.
이러한 차이는 회사가 직면하고 있는 위기 측면에서 회사의 각 부문이 동일선상에 놓일 필요가 있다는 점을 의미하므로 중요하다. 물론 우선순위가 충돌하는 경우가 존재한다.
예를 들어 제조 deviation을 거치고 있는 batch 방출에 있어서는 제조 수장(head) 보다는 품질 유닛이 더 엄격해 보일 수 있으며 제조 유닛은 회사의 경영관리(executive management) 보다 제한된 자원에 더욱 신경을 쓸 수 있다. 이러한 우선순위 갈등을 실사 이전에 인지하고 조정해 놓아야 한다.
Parexel Consulting의 제약 컴플라이언스 부사장인 Peter D. Smith도 FDA는 변화 조절, 제품 방출, 제품 리콜과 관련돼 결정수립 과정에서 도입된 위기관리 혹은 위기평가를 보는 걸 선호한다며 결정과정에 있어 위기 접근법에 대해 얘기한다면 좋은 인상을 줄 수 있을 것이라고 조언했다.
FDA의 과정 분석 기술 및 디자인에 따른 품질 등 최신 위기기
개의 댓글
댓글 정렬
BEST댓글
BEST 댓글
답글과 추천수를 합산하여 자동으로 노출됩니다.
댓글삭제
삭제한 댓글은 다시 복구할 수 없습니다.
그래도 삭제하시겠습니까?
그래도 삭제하시겠습니까?
댓글수정
댓글 수정은 작성 후 1분내에만 가능합니다.

