[팜뉴스=김응민 기자] 한미사이언스의 핵심 사업회사 한미약품이 체중 감량과 근육 증가를 동시에 실현하는 신개념 비만 혁신신약의 임상에 돌입했다.
한미약품은 4일(현지시간) 미국 식품의약국(FDA)으로부터 신약 후보물질 'LA-UCN2(코드명: HM17321)'의 임상 1상 진입을 위한 임상시험계획(IND)을 승인받았다고 6일 밝혔다.
이번 임상은 건강한 성인 및 비만 환자를 대상으로 HM17321의 안전성, 내약성, 약동학, 약력학 특성을 평가한다.
HM17321은 단순히 근육 손실을 방지하는 수준을 넘어, 지방 감량과 근육 증가를 동시에 구현하도록 설계된 '퍼스트 인 클래스(First-in-Class)' 비만 혁신신약이다.
기존 GLP-1 기반 약물들이 체중 감소와 함께 근육량 감소를 초래하는 한계를 보인 것과 달리, HM17321은 지방을 선택적으로 줄이면서 근육량을 늘리는 새로운 기전을 적용했다.
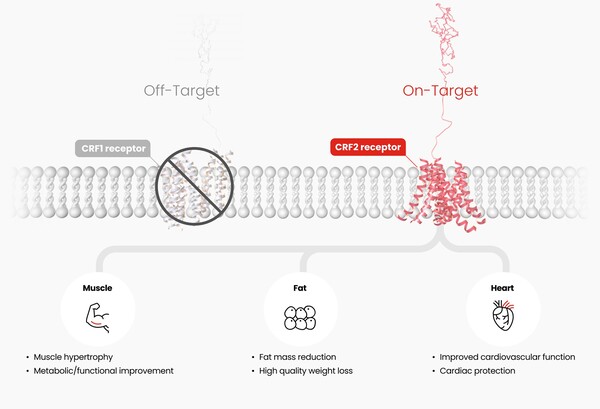
이 약물은 GLP-1 등 인크레틴 수용체가 아닌 CRF2(corticotropin-releasing factor 2) 수용체를 표적으로 하는 UCN2(Urocortin-2) 유사체 기반 펩타이드 치료제다.
한미약품 R&D센터는 자체 인공지능(AI) 모델링 및 구조 설계 기술을 통해 HM17321을 개발했으며, 비임상 연구에서 근육량 증가와 지방 선택적 감량, 운동 및 대사 기능 개선 효과를 확인했다.
CRF2 수용체는 스트레스 반응 조절 및 대사 기능 회복과 관련된 단백질로, 이를 선택적으로 자극할 경우 근육 기능 강화와 지방 축소를 유도할 수 있다.
이와 같은 기전으로 HM17321은 단독요법뿐 아니라 인크레틴 계열 비만 치료제와 병용 시에도 체중 감량의 ‘질적 향상’을 기대할 수 있다.
기존의 항체 기반 근육 보존 약물들은 정맥 투여 방식으로 인해 비만 환자에게 투약 편의성이 낮고, 피하 주사형 비만치료제와 병용 시 제형 차이로 인한 한계가 있었다.
HM17321은 펩타이드 기반 제형으로 투약 편의성과 생산 효율성을 높였으며, 동일 펩타이드 계열의 인크레틴 약물과 병용 투여 시에도 적용이 용이하다는 장점이 있다.
한미약품은 이번 신약 후보를 포함해 총 6개의 비만치료 파이프라인으로 구성된 'H.O.P(Hanmi Obesity Pipeline)' 프로젝트를 추진 중이다.
다층적 기전과 차별화된 전략을 통해 체중 감소 효과뿐 아니라 대사질환 개선을 목표로 하고 있다.
현재 H.O.P의 첫 번째 파이프라인인 '에페글레나타이드'는 임상 3상 중간 톱라인 결과에서 우수한 효능과 안전성을 확인했으며, 두 번째 파이프라인인 삼중작용제 'HM15275(LA-GLP/GIP/GCG)'는 7월 FDA로부터 임상 2상 승인을 받아 2030년 상용화를 목표로 개발 중이다.
이번에 FDA 승인을 받은 HM17321은 H.O.P의 세 번째 파이프라인으로, 한미약품은 2031년 상용화를 목표로 임상 개발에 속도를 내고 있다.
최인영 한미약품 R&D센터장(전무)은 "HM17321은 지방 감량과 근육 증가, 운동 및 대사 기능 개선을 동시에 지향하는 약물로 기존 치료제와 차별화된 기전을 갖고 있다"며 "비만을 단순한 체중 감량이 아닌 대사질환의 근본 원인으로 바라보는 관점에서, 환자 중심의 치료 솔루션을 제시해 나가겠다"고 말했다.
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

