
[팜뉴스=김민건 기자] 내달 1일부터 만성 중증 판상건선 치료에 빔젤릭스(비메키주맙), 폐동맥고혈압에 아뎀파스(리오시구앗) 급여 처방이 가능해진다.
JAK억제제 린버크(우파다시티닙)는 성인 류마티스 관절염을 비롯해, 중등도-중증 아토피염(만 12세 이상), 중증 활동성 강직성척추염, 중등도-중증 궤양성대장염, 중등도-중증 활성 크론병 등 다수 적응증 급여 기준이 기존 보다 명확해진 내용으로 적용된다.
팜뉴스 확인 결과, 보건복지부는 21일 빔젤릭스와 아뎀파스 급여 기준을 신설하고 린버크 급여 기준에 선행치료 등 내용을 구체화 시킨 '요양급여 적용 기준과 방법에 관한 세부사항' 일부 개정안을 고시, 오는 6월 1일부터 적용한다.
린버크 급여 기준은 이전에도 적용해왔던 내용이지만 평가 방법이나 MTX 사용, 교체투여 약물 기전 등을 더 구체화 시켰다. 일선 의료기관에서 처방 시 해석에 혼선을 겪지 않도록 했다.
■새로운 IL-17 A·F 이중억제 기전 신약
먼저, 이번 개정으로 IL-17 A·F 이중억제 기전 신약 빔젤릭스 급여 기준이 만들어진다. 투여 대상은 기본적으로 6개월 이상 지속되는 만성 중증 판상건선 환자(만 18세 이상 성인)이다.
세부적으로 ① 판상건선이 전체 피부면적(Body surface area) 10% 이상 ② PASI(Psoriasis Area and Severity Index) 10 이상 ③ MTX(Methotrexate) 또는 사이클로스포린을 3개월 이상 투여했에도 반응이 없거나 부작용 등으로 치료를 지속할 수 없는 경우 ④ 피부광화학요법(PUVA) 또는 중파장자외선(UVB) 치료법으로 3개월 이상 치료했지만 반응이 없거나 부작용 등으로 치료를 지속할 수 없는 경우에 따라 적용 여부가 달라진다.
①②③항 또는 ①②④항을 충족하는 경우 급여 적용을 받을 수 있지만, 피부광화학요법(PUVA)과 중파장자외선(Ultraviolet B, UVB) 모두 금기인 환자는 ①②③항 조건을 충족해야만 인정한다.
또한 ③항에서 MTX나 사이클로스포린을 3개월 이상 투여라는 기준에는 해당 치료로 부작용이 예상되거나, 부작용 발생으로 치료를 지속할 수 없는 만 18세 이상 성인 판상 건선에 DMF(Dimethyl fumarate)를 투여한 경우도 포함한다.
즉, MTX나 사이클로스포린 사용이 어려워 DMF를 처방한 경우도 면역억제제 사용 실패로 보고 급여 인정을 하겠다는 것이다.
급여를 받기 위해선 해당 약제를 16주 동안 사용한 후 PASI 지표를 평가해 75% 이상 감소해야 추가 6개월의 급여 투여를 인정한다. 이후 지속적으로 6개월마다 평가해야 하며, 최초 평가결과를 유지해야만 급여 처방이 가능하다.
교체 투여 대상 약제로는 TNF-a억제제 중에서 휴미라, 엔브렐, 레미케이드가 있다. IL-억제제 중에서는 코센틱스, 스카이리치, 스텔라라, 트렘피어, 탈츠가 있으며 TYK2억제제 중에선 소틱투, PDE-4억제제로 오테즐라(아프레밀라스트)가 있다.
교체 투여는 경구제 효과가 없거나 부작용으로 투약을 지속할 수 없는 경우, 복약 순응도 개선이 필요한 경우에만 투여소견서를 첨부해서 가능하다. 교체 약제는 최소 6개월 투여 유지가 권고된다.
■폐동맥 고혈압 치료에 새로운 희망

폐동맥 고혈압 치료에 새로운 희망으로 불리는 아뎀파스는 WHO 기능분류 단계 Ⅱ∼Ⅲ에 해당하는 폐동맥 고혈압 환자(WHO Group Ⅰ)로 진단된 환자에서 ①ERA 및/또는 PDE-5억제 폐동맥 고혈압 약제에 반응이 충분하지 않거나 ② ERA나 PDE-5억제 폐동맥 고혈압 약제에 모두 금기인 경우 급여 기준을 신설해 적용한다.
아뎀파스는 단독요법으로는 ERA계 또는 PDE5억제 기전 폐동맥 고혈압 약제에 모두 금기인 경우 급여 처방이 가능하며, 병용요법은 허가사항에 따라 투여 시에만 인정한다.
▶2제 요법의 경우 단독요법으로 3개월 이상 투여 후 임상 반응이 충분하지 않을 때(①∼④항 소견 중 최소 1개와 ⑤∼⑨항 중 최소 1개를 모두 만족), 작용 기전이 다른 약제 1종을 추가한 병용만 인정하는 것이다.
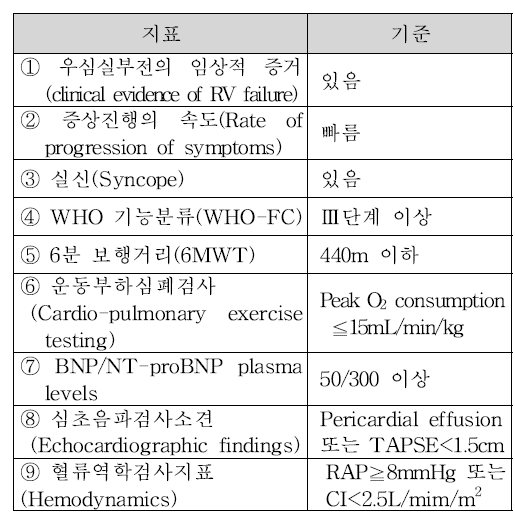
▶3제요법은 2제요법으로 3개월 이상 투여 후 임상 반응이 충분하지 않을 때(①∼④항 소견 중 최소 1개와 ⑤∼⑨항 중 최소 1개를 모두 만족), 2제 요법에서 사용하지 않은 다른 기전의 약제 1종을 추가한 순차적 병용투여를 인정한다.
추가 신설된 내용은 ▶PDE5 억제제 계열을 포함한 병용요법으로 3개월 이상 투여 후 임상 반응이 충분하지 않을 때(①∼④항 소견 중 최소 1개와 ⑤∼⑨항 중 최소 1개를 모두 만족) PDE5억제 기전 약물을 sGC계열로 교체투여 가능하며, PDE5억제제와 sGC억제제 병용투여는 인정하지 않는다는 것이다.
■류마티스 관절염, 아토피 등 5개 면역질환 치료 급여 적용
린버크는 성인 류마티스 관절염을 비롯해 5개 적응증에서 급여 기준이 명확해지고 세부적으로 바뀌었다.
먼저 류마티스 관절염 기준을 보면 2010년 미국류마티스학회(American College of Rheumatology, ACR)와 유럽류마티스학회(European League Against Rheumatism, EULAR)가 제정한 기준에 따라 진단받아야 한다.
선행치료 기준도 ▶MTX(methotrexate)를 포함한 두종류 이상의 질병조절 항류마티스제(Disease Modifying AntiRheumatic Drugs, DMARDs)로 총 6개월 이상(각 3개월 이상) 투여에도 효과가 미흡하거나 부작용 등으로 사용할 수 없는 경우 ▶앞서 조건으로 MTX 사용이 불가능한(간질환 또는 신부전 등) 경우 두 종류 이상의 DMARDs를 쓴 이후 ▶65세 이상, 심혈관계 고위험군, 악성 종양이 있는 경우 기존 TNF-a억제제 등 생물학적제제에 반응하지 않거나 내약성이 없는 경우의 조건을 '모두 충족'하도록 명확히 했다.
평가방법은 압통 관절수(Tender Joint Count, TJC), 부종 관절수(Swollen Joint Count, SJC), 환자의 전반적인 상태(Visual Analogue Scale, VAS) 등 질병활성도를 평가해 DAS28 5.1 초과나, DSA28 3.2~5.1이며 영상 검사상 관절 손상 진행이 있는 관절통·부종 등 중등도-중중 상태여야 급여를 인정한다.
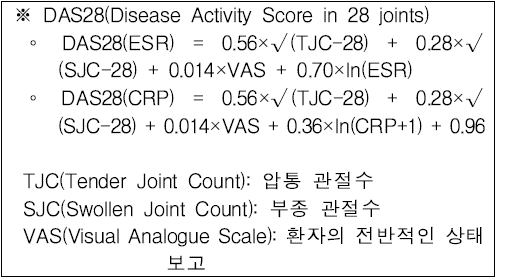
이전에는 ACR/EULAR 진단 기준에 부합한 경우로 했었는데 이제는 해당 기준에 따라 진단돼야 한다는 것이다.
특히, 기존에는 '6개월간 사용 후 평가 시 DAS28 1.2 이상 감소한 경우 추가 6개월 사용을 인정한다'와 '이후에는 6개월마다 평가해 첫 6개월때 평가 결과를 유지하면 지속 투여를 인정한다'는 문구를 '6개월 투여 후 '최초 평가'에서 DAS28 .12 이상 감소한 경우 인정'으로 변경해 평가 시점을 명확히 했다.
아울러 '이후 6개월마다 평가해 '최초 결과'를 유지 시 인정한다'고 바꿈으로써 그 기준도 정확히 했다. 첫 6개월 사용 후 평가 결과를 → '6개월 사용 이후 최초 평가'로 정리한 것이다.
특히 이번에 교체투여 항목을 신설하고 급여 기준 약제를 TNF-a억제제, T세포억제제, 인터루킨-6억제제, JAK억제제 기전별로 세부화했다.
대상 약제는 TNF-a억제제로 휴미라(아달리무맙), 엔브렐(에타너셉트), 심퍼니(골리무맙), 레미케이드(인플릭시맙)이다. T세포억제제로는 오렌시아(아바타셉트), IL-6억제제로 악템라(토실리주맙), JAK억제제로 올루미언트(바리시티닙), 지셀레카(필고티닙), 젤잔즈(토파시티닙)이다.
해당 약제에 효과가 없거나 부작용으로 지속 불가능하거나, 복약 순응도 개선이 필요한 있는 경우 투여소견서를 첨부해 교체함, 한 번 교체한 약제는 '최소 6개월 투여 유지'가 권고 사항이다.
만성 중증 아토피에서는 투여 대상이 성인(만 18세)과 청소년(만 12~17세)로 구분하던 것을 '만 12세 이상'으로 통일했다.
또한, 투약 개시일 6개월 이내 국소치료제나 전신면역억제제 투여 이력 확인이 필요한 내용은 '국소치료제(중등도 이상의 코르티코스테로이드 또는 칼시뉴린 억제제)를 4주 이상 투여했음에도 조절되지 않는 경우'로 변경했다. 이전에는 '적절히 조절되지' 않을 경우에서 '조절되지 않을 경우'로 바꾼 것이다.
아울러 '이후 전신 면역억제제(Cyclosporine 또는 MTX)를 3개월 이상 투여했음에도 반응(EASI 50%이상 감소)이 없거나 부작용 등으로 사용할 수 없는 경우' 항목을 별도 분리하고 65세 이상, 심혈관계 고위험군, 악성 종양 위험이 있는 경우 기존 치료제(생물학적 제제)에 반응하지 않거나 내약성이 없는 경우로 약제 사용을 한정했다.
이전에는 기존 치료에 '적절히 반응하지 않거나'로 규정한 것을 '반응하지 않거나'로 기준을 명확히 했다.
평가방법도 '투여 후 16주차 최초 평가'라는 시점을 정하고, 6개월마다 평가해 최초 평가결과를 유지하면 지속 투여를 인정한다는 기준을 → '6개월마다 평가에서 최초 평가결과를 유지 시 인정한다'고 정확한 기준을 규정했다.
중증 활동성 강직성 척추염도 이와 동일하게 '성인의 중증 활동성 강직성 척추염'으로 변경하고 16주 투여 이후 '최초 평가'라는 문구를 기재해 그 시점을 명확히 했다. 교체투여 대상 약제도 TNF-a(휴미라, 엔브렐, 심퍼니, 레미케이드)와 IL-17A(탈츠(익세키주맙, 코센틱스(세쿠키누맙)), JAK억제제(젤잔즈)로 기전별 구분을 뒀다.
성인의 중등도-중증 활동성 궤양성 대장염과 성인의 중등도-중증 활성 크론병도 기존과 동일하지만 평가 지표나 방법, 선행 치료 요건을 항목별로 구분함으로써 쉽게 해석할 수 있도록 했다.
주목할 부분은 '성인 활동성 또는 진행성 건선성 관절염' 급여 기준 신설이다.
린버크는 두 종류 이상의 DMARDs로 총 6개월 이상(각 3개월 이상) 치료했지만 효과가 미흡하거나 부작용 등으로 중단한 경우에 급여로 쓸 수 있다. 여기에 3개 이상의 압통 관절과 부종 관절을 1개월 간격으로 2회 이상 연속 측정한 결과가 있어야 한다는 조건이 붙는다.
다만, 65세 이상 또는 고위험군, 악성 종양 위험 환자는 기존 치료제(TNF 억제제 등 생물학적 제제)에 반응하지 않거나 내약성이 있는 경우에만 가능하다.
급여 평가방법은 3개월 투여 이후 최초 평가에서 활성 관절수 30% 이상 감소가 있어야 하며 이후 6개월마다 평가에서 최초 결과를 유지해야 급여 인정이 가능하다.
교체투여 급여 기준에는 TNF-a억제제로 휴미라, 레미케이드, 심퍼니, 엔브렐이 있고, IL-7억제제로 탈츠, 코센틱스가 있다. IL-23억제제로는 스텔라라(우스테키누맙), IL-23억제제로 트렘피어(구셀쿠맙), 스카이리치(스카이리치), PDE-4억제제로 오테즐라(아프레밀라스트) 등이 대상 약제이며, 교체 이후에는 최소 6개월 투여 유지가 권고된다.
관련기사
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

