[팜뉴스=김민건 기자] MSD(미국 머크)가 차세대 폐동맥 고혈압 치료 경쟁에서 앞서가고 있다. 작년 3월 STELLAR 연구에 기반한 새로운 기전의 첫 번째 신약 윈레브에어(소타터셉트) 승인을 받은 데 이어 고위험군까지 적응증 확대에 성공했다.
글로벌 제약사들이 폐동맥 고혈압 치료 시장을 눈여겨보는 가운데 이룬 성과다.
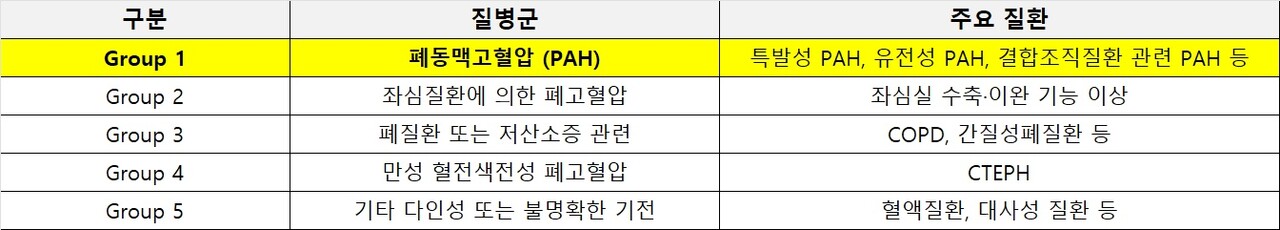
최근 미국 FDA는 MSD 윈레브에어 45mg, 60mg 제형을 WHO 그룹1에 속한 폐동맥고혈압 중증도(기능등급 III단계 또는 IV단계) 성인에서 치료 효과를 인정했다.
폐동맥고혈압은 폐소동맥 벽이 비정상적으로 두꺼워지고 협착해 압력이 올라가는 희귀·중증 난치질환이다. 좁아진 폐동맥은 우심실 압력을 높이며 오른쪽 심장 기능이 점진적으로 약화, 돌연사 위험을 증가시킨다.
윈레브에어는 20년 만에 등장한 새로운 기전의 신약으로 과다하게 발현되는 액티빈 신호 억제제(ASI)다. 비정상적으로 두꺼워진 혈관 증식을 억제하고, 변형된 폐혈관 구조를 개선하는 치료제다.
액티브 신호 억제제(activin signaling inhibitor)로 FDA로부터 성인 폐동맥고혈압(PAH, WHO 그룹 1 폐고혈압) 환자의 운동능력 및 WHO 기능 등급(FC) 개선, 그리고 입원, 폐이식, 사망을 포함한 임상적 악화 사건 위험 감소를 위한 치료제로 승인을 받았다.
이번 승인 확대는 WHO 기능등급 III 또는 IV인 성인 폐동맥고혈압 환자 127명을 대상으로 한 3상 연구 'ZENITH'가 근거였다. 연구에서 윈레브에어 86명, 위약 대조군을 86명 설정했다.

임상에 참여한 환자들은 특발성 PAH(50%), 결합조직질환 관련 PAH(28%), 유전성 PAH(11%) 등이었으며 진단 후 경과 기간은 평균 8년이었다. HIV 관련 PAH, 문맥고혈압 관련 PAH, 폐정맥폐쇄성질환(PVOD), 모세혈관 혈관종증 환자는 제외했다. WHO 기능등급은 III형이 74%, IV형이 26%였다.
임상 시작 당시 환자 중 72%가 3제요법을 사용하고 있었고, 28%가 2제요법을 하고 있었다 .이들 중 59%가 프로스타사이클린 계열을 병용했다. 이후 임상 연구에서 윈레브에어와 위약을 각각 투여했다.
연구 결과, 윈레브에어를 기존 치료요법과 병용한 환자들은 주요한 사망, 폐 이식, 입원 등 임상적으로 상태가 악화하는 사건이 발생하는 시간이 위약군 대비 76%(HR 0.24)나 줄어든 것을 확인했다. 주요한 사건 발생에서 윈레브에어는 17%였으며, 위약군은 55%였다.
윈레브에어는 위약군 대비 압도적인 치료 효과로 임상을 조기 중단했으며, 나머지 기간 위약군에 배정된 환자는 맹검을 해제하고 공개연구로 전환, 윈레브에어를 투약하는 장기 추적관찰에 들어갔다. 윈레브에어를 투약한 평균 기간은 435일, 위약군은 268일이었다.
이 과정에서 이상반응으로 치료를 중단한 환자는 윈레브에어는 1명(1%)이었으며, 위약군은 4명(5%)이었다.
윈레브에어의 이번 결과는 기존 치료요법만 사용했을 때 입원(24시간 이상 지속된 악화로 인한 경우)과 사망 사건 발생율이 높은 고위험군이었다는 점에서 의미가 있다.
폐동맥고혈압 치료 시장은 현재 주요 글로벌 제약사들이 주목하고 있는 새로운 질환 영역이다. 향후 시장 규모는 수조 원 규모로 확대될 전망이다.
미국에선 약 4만 명의 환자가 있는 것으로 추정된다. MSD는 이번 적응증 확대가 폐동맥 고혈압 치료 패러다임의 중요한 전환점으로 여길 정도의 결과다.
국내에서는 올해 7월 식품의약품안전처 허가를 받아 사용 가능해졌다. 아직 비급여 품목으로 건강보험 적용이 추진 중이다.
식약처(허가)-건강보험심사평가원(급여 평가)-건강보험공단(약가협상)을 동시에 진행하는 '허가-평가-협상' 2차 시범사업에 선정돼 있다.
한국은 해외보다 폐동맥고혈압 치료 옵션이 부족하다. 이번 적응증 확대로 중등도 환자에서도 윈레브에어 치료 효과가 확인된 만큼 급여화 중요성이 커졌다.
키워드
#윈레브에어관련기사
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

