[팜뉴스=김민건 기자] 자궁내막암 치료 전략이 PD-1 면역항암제 젬퍼리(성분명 도스탈리맙) 중심으로 재편될 가능성이 높아지고 있다. 최근 국내 적응증 확대에 성공하면서 키트루다(펨브롤리주맙)를 넘어섰다.
이번 허가를 통해 국내 자궁내막암 1차에 허가된 첫 면역항암제, 1·2차 치료 모두 허가된 첫 면역항암제라는 타이틀을 얻었다.
이달 7일 식품의약품안전처는 젬퍼리의 재발성∙진행성 고빈도 현미부수체 불안정(MSI-H)/불일치 복구결함(dMMR) 자궁내막암 1차 치료 적응증 확대를 승인, 새로운 치료 옵션이 처방 가능해졌다.
젬퍼리 1차치료 허가 근거가 된 RUBY 연구는 자궁내막암 치료에 중요한 발전을 이끈 글로벌 3상 임상으로 평가한다.
이 연구는 젬퍼리와 백금기반 화학요법(카보플라틴+파클리탁셀) 병용한 이후 젬퍼리를 단독 투여하는 방식과 위약+백금기반 항암화학요법을 병용 후 위약을 단독 사용하는 식으로 젬퍼리와 항암화학요법 병용 시 효능, 효과를 중점적으로 평가했다.
임상에는 3·4기 원발 진행성과 재발성 환자 494명이 참여했으며 이들 중에는 고빈도 현미부수체 불안정(MSI-H)/불일치 복구결함(dMMR)을 가진 환자 118명이 포함됐다.
1차 평가변수는 무진행 생존율(Progression Free Survival, PFS)이었다. 임상 결과, 젬퍼리+항암화학요법 병용 시 MSI-H/dMMR 환자에서 추적관찰 중앙값 24개월 시점에 무진행 생존율 61.4%를 기록하며, 위약 대조군 15.7% 대비 사망 위험과 질병 진행 위험을 72%나 줄일 수 있었다.
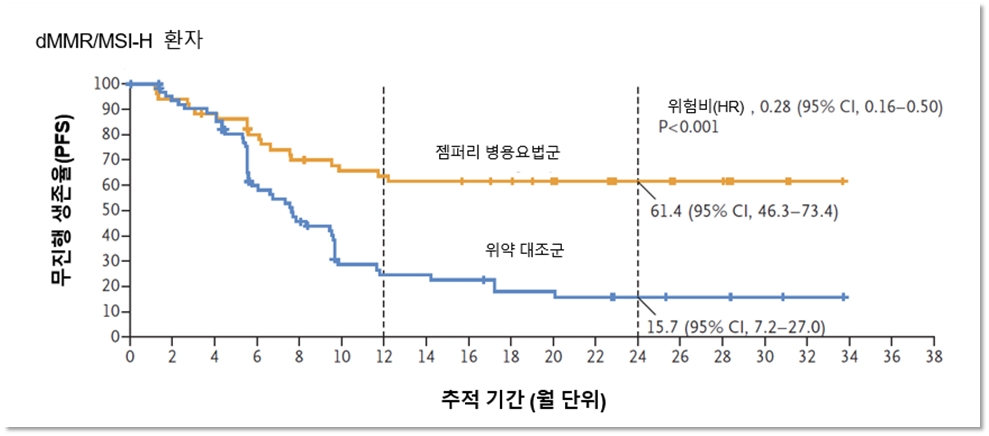
MSI-H/dMMR 환자군이 2년간 60% 이상 생존했다는 것은 자궁내막암 1차치료에 중대한 영향을 미칠 수 있는 결과다. 국내 임상 현장에서 자궁내막암 환자의 질병 진행을 유의미하게 늦출 수 있다는 의미이기 때문이다.
2021년 자궁내막암을 포함한 자궁체부암 치료 환자는 모두 2만3262명으로 지난 2017년 1만7421명 대비 약 33.5% 증가했다. 2020년 기준 가장 큰 폭의 사망률 증가가 예상될 만큼 미충족 수요가 크다.
이에 반해 치료 환경은 제한적이다. 자궁내막암 환자 4명 중 1명은 진행성에 해당하거나 재발을 경험하며, 백금기반 항암화학요법 후 질환 재발 시 사용할 수 있는 치료법에 한계가 있다. 1차 항암화학요법 이후 자궁내막암의 진행 또는 재발 시 2차 항암화학요법을 받은 환자의 전체 생존 기간은 10개월에 불과하다.
특히 진행성∙재발성 자궁내막암 1차치료에서 카보플라틴과 파클리탁셀을 병용하는 백금기반 항앙화학요법은 큰 효과를 기대할 수 없었다.
젬퍼리가 국내 2차 치료 허가 적응증 획득 1년 만에 건강보험 급여에 빠르게 등재될 수 있었던 것도 dMMR/MSI-H를 비롯한 진행성·재발성 환자에서 무진행 생존율과 전체 생존율 모두 개선, 환자의 생존 기간을 연장시킬 수 있었기 때문이다.
젬퍼리와 경쟁 관계인 MSD 면역항암제 키트루다는 진행성·재발성 자궁내막암 2차에서 dMMR/MSI-H가 있는 환자는 키트루다 단독으로, dMMR/MSI-H가 없는 경우 렌비마(렌바티닙) 병용으로 쓸 수 있다.
임상 현장에서는 1차치료에 키트루다를 허가초과 약제로 사용 중이지만, 진행성·재발성 자궁내막암 2차치료 급여 획득에 애를 먹고 있다.
젬퍼리는 dMMR/MSI-H가 있는 환자에서만 사용할 수 있다. 다만 RUBY 연구에서 보였듯 dMMR/MSI-H 바이오마커가 없는 환자에서도 효과를 보여 국내 치료 전략을 재편하는 유리한 위치에 섰다.
특히 GSK는 젬퍼리의 1차치료 급여 도전에 속도를 낼 것으로 전망된다. 이 경우 의료 현장에서는 자궁내막암 1,2차 치료 모두 급여를 이룬 젬퍼리 처방이 수월할 수밖에 없다.
한편, 자궁내막암은 자궁 체부 내벽을 구성하는 자궁내막에서 생기는 암으로 자궁체부암 대부분을 차지한다.
젬퍼리는 IgG4 인간화 단클론항체로dMMR/MSI-H 암종에 지속적인 항종양 활성을 보이는 PD-1 저해제(Programmed Death receptor-1 Inhibitor)로 국내 자궁내막암 2차치료에 허가와 급여를 가지고 있다.
지난 2022년 12월 식약처 허가를 받아 백금기반 전신 화학요법 치료 중이거나 치료 후 재발 또는 진행성인 dMMR/MSI-H 자궁내막암 성인 환자에서 급여 사용이 가능하다. 근거 임상은 GARNET이다.
미국식품의약국(FDA)과 유럽의약품청(EMA) 모두 자궁내막암 1차치료에 젬퍼리를 승인했으며, 국내 및 글로벌 가이드라인에서는 dMMR/MSI-H 바이오마커 식별을 위해 유전성 자궁내막암 선별검사를 시행할 것을 권고하고 있다.
관련기사
- 젬퍼리, 자궁내막암 2차치료 환자부담 200만원...최대 2년까지 적용
- 자궁내막암서 엎치락뒤치락 면역항암제, 멈칫한 키트루다 영향력 넓히는 젬퍼리
- 키트루다, 국내 3대 부인암 적응증 모두 받아...자궁경부암 1차 허가
- 젬퍼리, 자궁내막암 3상 OS ·PFS 데이터 보강...추가 데이터로 입지 공고히 다져
- [창간특집] ② '항암플레이어 GSK' 10년 만에 화려한 컴백..."빅파마 R&D 정점 보여줄 것"
- 키트루다·린파자 병용, 비편평 비소세포폐암 1차치료서 드러낸 부족함
- 자궁내막암 진행·재발성도 3년 이상 생존 '젬퍼리', 면역항암 1차 급여화 시대 열까
- 자궁내막암 면역항암치료, 이제 1차 치료 시대가 온다
- "자궁내막암 환자가 행복한 순간 언제일까 고민, 가장 좋은 치료제로 최대한 재발 억제하는 것"
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

