[팜뉴스=최선재 기자] '특허권 연장기간 상한캡'은 업계 최대의 화두다. 지난 4월 특허청과 국회를 중심으로 특허권 존속기간에 일종의 상한선(캡)을 두어야 한다는 내용의 개정안이 발의됐다. 최대 5년이란 상한을 두고 있지만 전체 존속기간에 대한 제한이 없다는 이유에서다.
그 이후 한국제약바이오협회(KPBMA)와 글로벌의약산업협회(KRPIA)의 입장이 엇갈렸다. KPBMA는 찬성을, KRPIA는 반대했다. KPBMA의 회원사는 대부분 국내 제약사다. KPPIA는 글로벌 제약사가 주축 회원이다.
특허권 연장에 상한 캡을 적용할 경우, 글로벌 오리지널사들은 불리하다. 반면 국내 제네릭사들은 유리하다. 공고한 특허권 시장을 뚫어내고 제네릭 포문을 열어젖힐 수 있다는 계산 때문이다.
개정안 발의를 계기로 두 단체가 여전히 첨예한 대립을 이어가는 가운데, 김용 특허청 과장(약학박사)이 지난 8일 "의약품 특허연계 하반기 교육"에서 주요국 사례를 통해 상한캡 설정의 필요성을 역설하면서 업계의 이목이 집중됐다. 김 과장의 현장 목소리를 전한다.
# 특허권 존속기간 최대 5년이 원칙
'의약품 특허권 존속기간 연장 제도'는 의약품·농약 허가 등에 장기간(임상시험 및 품목허가 검토기간)이 소요되어 발생하는 특허권 불실시 기간을 최대 5년의 기간 내에서 연장해 보상하는 개념이다. ('두 개의 판결'로 살펴보는 '의약품 특허 존속기간 연장 이슈' 보도 참고)
여기서 "존속기간 연장을 얼마나 인정해줄 것이냐"가 쟁점이다. 특허 출원인 입장에서는 최대한 연장해서 기간을 늘려야 하는 반면 제네릭사는 존속기간이 빨리 끝나길 바라기 때문이다.
일단 특허법(89조)에는 최대 5년이란 상한만 규정됐고 구체적인 내용은 고시(제2019-3호, 특허권 존속기간 연장제도 운용에 관한 규정)에 규정됐다.
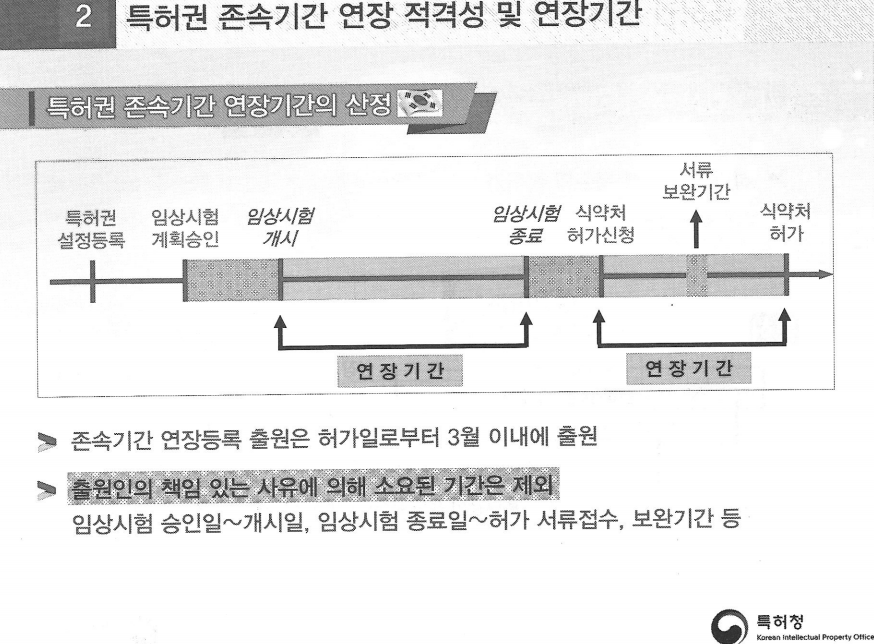
# 5년까지 인정 '서류 보완 기간' 제외 (그림1 참고)
특허청 고시에 따르면 '불실시 기간(실시할 수 없었던 기간)'은 '식약처장의 승인을 얻은 임상 기간'과 '식약처에 소요된 허가신청 관련 서류 검토기간'을 합산한 기간을 뜻한다.
위 그림1으로 살펴보자, 식약처에서 임상계획승인을 승인했다. A제약사가 임상을 개시하고 종료했다. 그 이후에 A제약사가 품목허가 신청을 하고 식약처의 보정명령을 거친 후 허가를 받았다.
존속기간 연장은 빗금이 쳐진 대목(임상계획승인~개시, 허가신청~식약처 허가)까지 가능하다. 다만 출원인의 책임 있는 사유에 의해 소요된 기간은 제외한다. 허가신청~허가 사이에 A제약사가 서류 보완명령을 받는 기간은 연장기간에 포함되지 않는다.
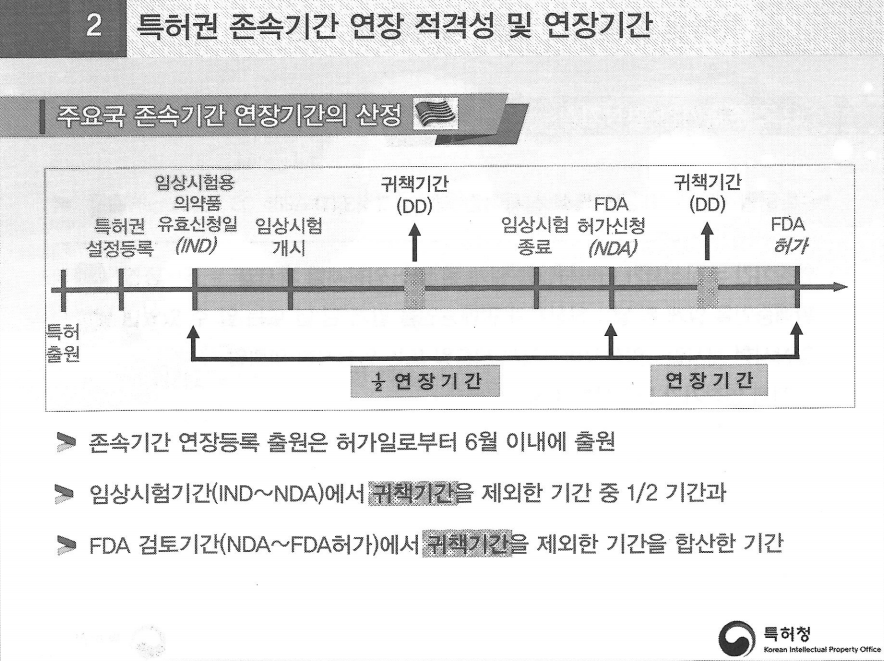
# 미국도 '불실시 기간' 인정...But 14년 '상한캡' 있다! (그림2+그림3)
미국은 복잡하지 않고 간단하다. 우리는 임상시험 개시일부터 종료일만큼 연장해주고 임상 종료 이후 식약처 허가신청 기간까지는 제외하지만 미국은 전부 포함한다.
즉, IND(임상시험용 의약품 유효신청일)부터 NDA(품목허가신청일)까지 존속기간 연장일수에 합산한다.
다만 미국은 IND부터 NDA까지 기간의 절반(1/2)만 인정한다. 여기에 FDA 허가 서류 검토기간을 더한다.
더욱 중요한 사실은 미국은 '14년'이란 존속기간 상한캡이 있다는 점이다.
예를 들어 B제약사가 2004년 특허를 출원하고 2011년 8월 26일 의약품 품목허가를 받았다고 가정해보자.
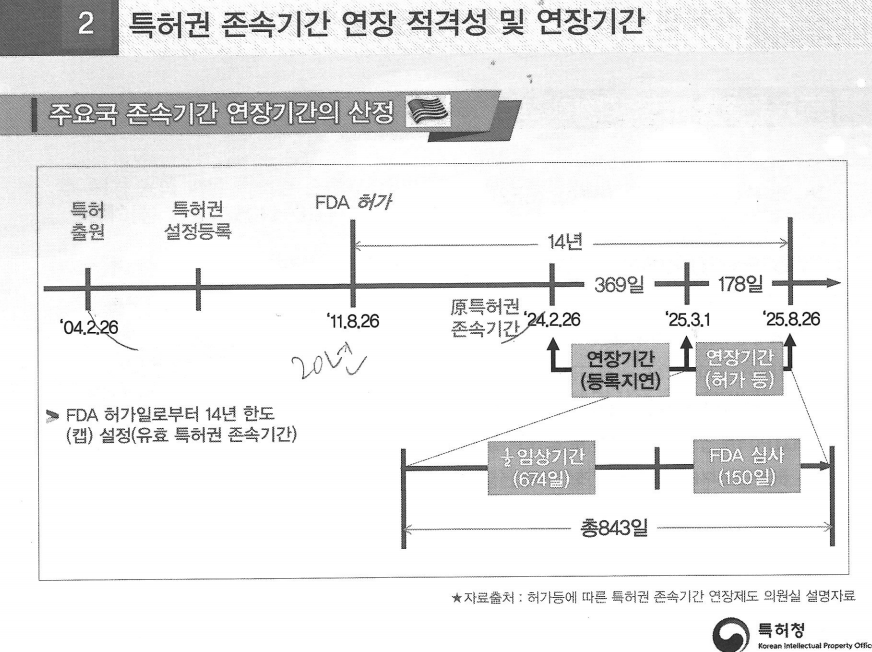
원칙적으로 특허권 존속기간(20년)의 만료일은 2024년 2월 26일이다. 하지만 미국 특허청이 심사를 하다가 지연이 됐고 1~2년이 지난 뒤 등록됐다면 미국도 해당 기간에 대한 연장을 해준다.
특허권 존속기간 등록 지연을 사유로 369일을 해줘서 특허권이 연장된 이유다. 결국 특허권 존속기간 만료일이 2025년 3월 1일로 369일 연장됐다.
여기에 전체 IND부터 NDA까지 임상기간의 절반인 674일과 FDA 심사 소요 기간 150일이 합산됐다.
그렇다면 특허권 존속기간 연장 기간이 843일(674일+150일)이어야 하는데 결론적으로 B제약사는 178일만 인정받았다.
미국이 특허권 존속기간 상한캡을 '14년'으로 두고 있기 때문이다. 14년이 넘어가면 제동이 걸린다.
실제로 843일을 연장했다면 특허권 존속기간을 16년 정도까지 인정해야 하는데 미국 현행법은 14년까지다. 때문에 미국의 연장기간 산정방식 상한캡에 따라 그 이후에는 178일만 인정해준 것이다.
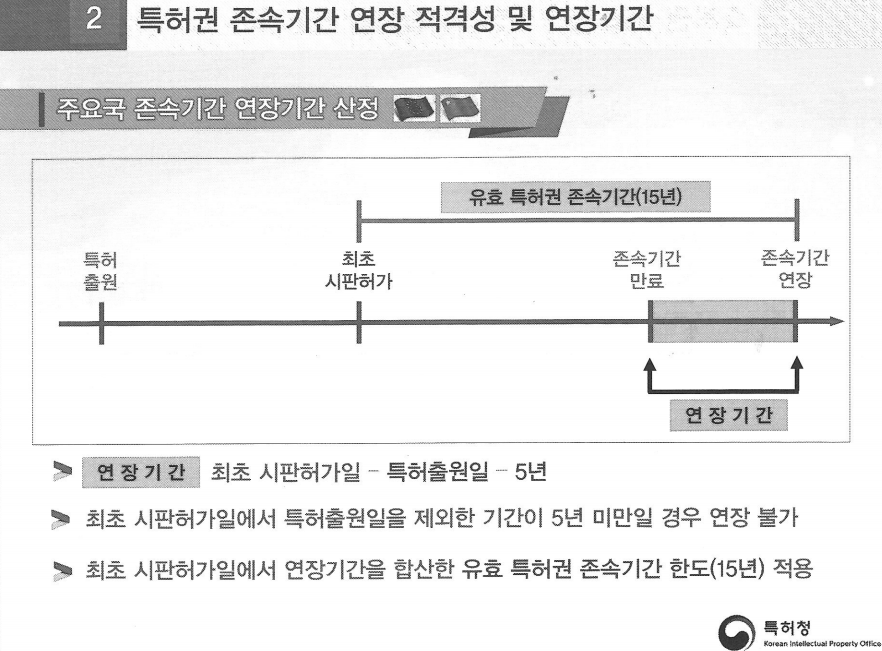
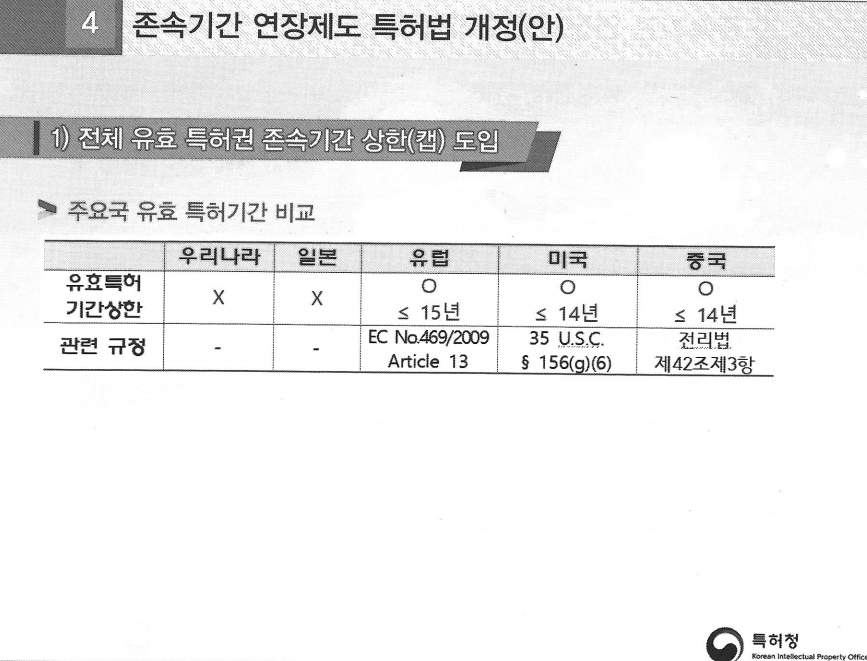
# 유럽·중국도 상한캡 '15년', 그런데 우리만 왜? (그림4)
유럽은 특허 존속기간 연장 산정에 임상 기준 자체를 요구하지 않는다. 만약 의약품이 최초 시판 허가를 받으면, "연장기간 = 최초 시판허가일–특허출원일–5년"이다.
예를 들어 C 제약사가 유럽에서 특허 출원을 2000년 1월 1일에 받고 시판 허가를 2010년 1월 1일 받았다고 가정하자.
그렇다면 최초시판 허가일 2010년 1월 1일에서 2000년 1월 1일을 빼면 10년이다. 여기서 5년을 더 빼면 존속기간은 연장기간을 포함해 5년으로 간단하다.
최초 시판일에서 특허 출원일을 제외한 기간이 5년 미만이면 연장이 불가하다. 즉 최초 특허출원일이 2000년 1월 1일이고 최초 시판 허가가 2005년 1월 1일이었다면 2005년 1월 1일에서 2000년 1월 1일을 빼면 5년, 여기서 5년을 또 빼면 0이다. 존속기간 연장이 안 된다.
유럽도 상한캡을 적용하기 때문에 전체 특허 기간(연장포함)은 아무리 길어도 15년을 넘지 못한다. 중국도 2021년 법 개정한 뒤로 유럽과 같이 15년 상한캡 제도가 있다. 미국, 중국, 유럽 전부 유효특허권 존속기간이 일정하게 적용된다는 뜻이다. 이것이 우리나라와의 차이다.
# 제네릭 도입 시점 '빠르게', 국제 조화도 '알맞게' (그림5)
존속기간 연장 제도 운영 국가는 5개국이다. 우리나라는 빠른 편이었다. 미국이 1984년이지만 우리가 일본, 유럽, 중국보다 먼저 도입했다. 연장기간은 5년으로 5개국이 전부 같은데 기간 상한이 없는 곳은 우리나라와 일본 뿐이다.
일본은 특허 존속기간 연장에 관대한 나라다. 웬만하면 기간을 연장을 해주는데 효력범위가 굉장히 협소하기 때문에 우리와 상황이 다르다. 일본이 미국, 중국,유럽처럼 14~15년의 전체 상한선을 두지 않고 있는 이유로 풀이된다.
그런 측면에서, 지난 4월 발의된 개정안은 중요하다. 미국, 유럽, 중국처럼 우리도 캡을 도입하자는 것이 개정안의 골자다. 연장기간을 포함한 존속기간을 다른 나라처럼 14년으로 제한하는 내용이다.
캡을 두면 제네릭이 빨리 나올 수 있고 의약품에 대한 조기 접근권 확보가 가능하다. 건보재정 절감 효과도 따라온다. 주요국들과의 국제적 조화의 측면에서도 검토할 만한 대안이다.
지난 4월 정일영 의원이 개정안을 대표발의한 이후, 7월 12일 산업통상자원중소벤처기업위원회전체회의에 상정됐다. 조만간 소위에 올라갈 예정인데 향후 어떻게 될지 귀추가 주목된다.
관련기사
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

