[팜뉴스=최선재 기자] 식약처가 기등재 제네릭 의약품에 대한 재평가를 진행할 때마다 제약사 담당자들의 책상엔 각종 서류와 공문이 수북하다. 식약처에 제출할 자료 준비 때문이다.
생물학적 동등성 입증에 실패할 경우 회사의 메인 제품이 순식간에 날아갈 수 있기 때문에 이들은 ‘잠 못 이루는 밤’을 보낸다.
식약처가 2007년부터 본격 추진한 제네릭 의약품 재평가 작업은 어느덧 15년차에 접어들었다. 이제는 제네릭 재평가는 제약바이오 업계의 역사로 자리잡았다고 해도 과언이 아니다.
식약처는 최근 또 다시 업계를 대상으로 대규모 재평가 계획을 발표했다. 팜뉴스는 12일 ‘의약품 재평가 정책설명회’에서 의약품안전평가과(식품의약품안전평가원) 하윤정 주무관의 발표 내용을 토대로 제네릭 의약품 재평가의 역사를 들여다봤다.

# 우수 의약품 공급 취지...2007년 ‘정제, 좌제, 캡슐제’ 재평가 돌입
식약처 정의에 의하면 제네릭 의약품 재평가는 기존의 허가나 신고된 의약품에 대해 최신 과학 수준에서 안전성과 유효성을 재평가해서 안전하고 우수한 의약품을 공급하고 의약품 사용의 합리적인 적정성을 기하기 위한 제도다.
재평가 방법은 두 종류다. 생물학적 동등성 시험(이하 생동시험)은 주성분의 혈중농도를 측정하는 방식으로 생체 이용률의 동등성을 확인한다.
원칙적으로 생동시험을 통해 동등성을 입증해야 하지만 제형이나 작용 기전에 따라 이화학적 동등성 실험으로 대신할 수도 있다. 제네릭이 대조약과 동등한 효과와 안전성을 지녔다는 점을 증명하면 된다.
식약처발 제네릭 재평가의 원년은 2007년이었다. 식약처는 2006년 12월 의약품 동등성(이하 의동) 고시를 통해 전문약 중 동등성 확보가 필요한 성분을 지정하고 ‘정제, 좌제, 캡슐제’ 허가 시에 생동성 시험을 의무화했다.
이듬해부터 동시에 의동 확보 성분을 함유한 전문약 중 ‘정제. 캡슐제, 좌제’를 대상으로 기허가 품목에 대한 재평가 작업을 진행했다. 여기서 의동 확보 성분은 “의약품 동등성 확보 필요 대상 의약품으로 지정(식약처 고시)된 521개”를 뜻한다.

# 무려 10년간 재평가...360개 성분 ‘생존’
정제는 의약품을 일정한 형상으로 만든 알약이다. 캡슐제도 의약품을 액상, 현탁상, 반고형상, 분말상, 과립상, 또는 성형물의 형태로 캡슐에 충전하는 알약 형태의 고형제제다. 좌제(坐劑)는 보통 주성분을 기제에 고르게 섞어 일정한 형상으로 성형하여 항문에 적용하는 고형 외용제다.
놀라운 사실은 ‘정제, 좌제, 캡슐제’ 재평가 작업이 2007년부터 2017년까지 10년 동안 이뤄졌다는 점이다.
이른바 ‘많이’ 팔리는 약부터 시작됐다. 재평가는 2007년 보험 급여액이 많고 보험 약가 차이가 큰 품목 등 동등성 확보가 우선 필요한 품목을 대상으로 이뤄졌다.
2010년부터는 전문약(정제, 좌제, 캡슐제) 중 보험 청구액 또는 생산수입실적 기준 상위 성분이 재평가됐다. 그 결과 총 360개 성분, 5907품목에 대해 생동성 입증이 완료됐다.

# 산제·과립제...점안제, 점이제, 폐흡입제, 외용제제도 평가해라!
재평가 역사는 지금도 현재진행형이다. 2016년 10월 의약품 동등성 의무 제형 확대에 따라 산제, 과립제 등 5개 제형에 대해서도 재평가가 예고됐다. 결국 산제·과립제에 대한 동등성 재평가가 진행됐고 지난해 6월 실데나필 등 15개 성분, 81개 품목에 대해 동등성 입증이 완료됐다.
여기서 그치지 않았다.
식약처는 산제 과립제 재평과 결과 발표와 동시에 제약사를 대상으로 점안제, 점이제, 폐흡입제, 외용제제 379개(111개사) 품목에 대해 재평가 실시를 공고했다. 점안제는 레보플록사신 등 207개, 점이제는 오플록사신 등 7개, 폐흡입제는 살부타몰 등 18개, 국소 외용제제는 트레티노인 등 108개, 전신 외용제제는 리바스티그인 등 39개 품목이었다.
제약사들은 지난해 말까지 동등성 입증 자료를 제출했다. 식약처는 자료 검토 이후 지난 5월 31일 제약사들을 대상으로 보완 사항을 전달했다. 주요 보완사항은 대조약 선정의 타당성 입증자료, 첨가제 신청사항에 대한 객관적 근거 자료였다.
특히 제제의 특성을 고려한 이화학적 동등성 시험 자료 중 입자도, 방출시험 등에 대해 보완사항이 다수 나왔다. 보완 자료 제출기한 2개월, 다음달(8월) 1일까지 제출 가능하다. 다만 제약사들은 사유서를 제출하고 타당성을 입증하면 보완서류 제출 기간 연장을 할 수 있다.
# 기등재 제네릭 ‘전부’에 대해 재평가 진행하겠다
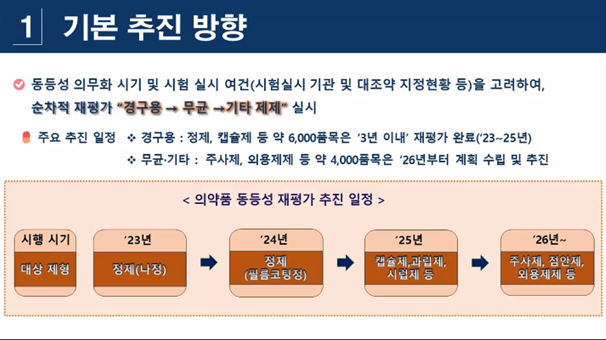
제네릭 의약품 재평가 역사의 미래는 밝다. 식약처가 2020년 10월 제네릭 품질과 신뢰성 향상을 위해 신규 품목 허가시 특정 성분 또는 제형 품목이 아니라 전(모든) 성분 제형 품목으로 생동성 시험 의무화를 확대하는 내용의 고시를 개정했기 때문이다.
의동확보 성분 고시 외에 제형들도 재평가 대상이다. 이미 10년간 재평가 작업이 진행된 정제, 좌제, 캡슐제 중 의동확보 외 성분들도 포함됐다.
이뿐 아니다. 무균·기타 제제 등 전체 성분과 제형으로 재평가 대상이 전반적으로 확대됐다. 당장 내년부터 레보드로프로피진 등 130개(정제, 나정) 2024년엔 암로디핀 등 420개 성분(필름코팅정)을 대상으로 재평가가 진행될 예정이다.
2025년엔 피록시캄 등 286개 성분(캡슐제, 과립제, 산제, 시럽제, 액제)이 재평가 대상이다. 식약처에 따르면 정제, 캡슐제 등 약 6000개 품목은 3년 이내로 재평가를 완료할 예정이다. 무균·기타 제제(주사제, 외용제제 등) 4000개 품목은 2026년부터 계획을 수립하고 추진할 계획이다.
재평가 진행 결과 동등성 결과가 ‘적합’이면 생동 인정품목으로 공고되지만 그렇지 않다면 해당 제네릭은 퇴출이다. 비동등, 즉 부적합 판정이 나오면 회수 절차를 밟는다. 제네릭 재평가 역사가 이어질수록, 제약업계 담당자들의 ‘잠 못 이루는 밤’이 끝나지 않을 전망이다.
관련기사
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

