
[팜뉴스=김민건 기자] 국회 국민동의청원이 신약 허가와 급여 승인을 바라는 중증 암 환자들의 소통 창구가 되고 있다.
문제는 국민동의청원이 소통창구로 활발해진 배경이다. 소수인 환자 목소리를 낼 수 있는 공간이 부족하기 때문이다. 의약품 허가·정책 주무부처를 맡는 식품의약품안전처, 건강보험심사평가원, 국민건강보험공단의 의약품 허가·급여 등재 과정에 환자와 보호자 목소리가 소외돼 있다는 것을 보여준다.
2일 국회 국민동의청원에는 HER2 표적치료제 엔허투(트라스투주맙데룩스테칸), EGFR엑손20 T790M 변이 표적치료제 타그리소(오시머티닙), BRAF V600E 변이 표적치료제 비라토비(엔코라페닙)에 대한 청원이 올라와 있다.
전이성 유방암 치료제 엔허투는 작년 8월(신속 승인 요청)과 올해 2월(건강보험 승인) 올라온 2건의 안건이 청원 요건인 '5만 명' 동의를 달성했으며, 지난 2월 14일부터는 HER2 저발현 유방암으로 적응증 확대를 요구하는 청원이 진행 중이다.
엔허투는 절제 불가능하거나 전이성 HER2 양성 유방암 3차(DESTINY-Breast01 임상), 2차(DESTINY-Breast03) 치료 적응증을 가지고 있다. DESTINY-Breast01 임상에서 캐싸일라(T-DM1) 등 2개 이상 치료를 받은 환자를 대상으로 객관적반응률(ORR) 60.9%, 무진행생존기간 중앙값(mPFS) 16.4개월, 반응지속기간 중앙값(mDOR) 14.8개월을 기록했다.
엔허투 청원이 성립된 2건의 내용을 보면 가장 먼저 작년 8월 "신속허가 대상으로 지정됐지만 1년 이상 지나서도 식약처 허가가 이뤄지고 있지 않다"며 빠른 식약처의 승인을 요구하는 내용이 올라왔다.
당시 청원인 나모 씨는 "신약 엔허투가 기존 항암제와 비교해 질병 진행과 사망 위험을 72%까지 낮추는 기염을 토했고 미국임상종양학회(ASCO)에서 기립박수를 받았지만 우리나라에서 신속허가대상으로 지정된 지 1년 이상이 지난 지금도 허가가 나지 않아 투약이 요원한 상황"이라고 밝혔다. 청원이 올라오면서 국민 5만 명이 참여, 한 달 뒤인 9월 19일 식약처 허가가 나왔다.
엔허투 관련 다음 청원은 올해 1월 30일로 엔허투 건강보험 승인을 촉구하는 내용이었다. 이 청원도 지난 2월 3일까지 국민 5만 명 동의를 받아 요건을 충족했다.
유방암 4기 어머니를 돌보는 청원인 임모 씨는 "엔허투가 국내 허가를 받았지만 1회 주사에 500만원이 드는 상황이다. 아주 효과적인 항암제로 평가받고 있지만 너무 고가의 약으로 저희 가족을 비롯한 일반이 대부분 주사를 맞을 수 없는 현실이다. 조속한 건강보험 승인을 촉구한다"고 올렸다. 최근 개발되는 대다수 항암 신약들이 그렇듯 건보 적용 없이는 사용하기 어려운 고가 투약 비용에 어려움을 겪고 있었다.
현재는 엔허투의 또 다른 적응증인 HER2 저발현 유방암 허가 확대 요구 청원이 진행 중이다. 지난 2월 14일 시작한 청원에 3월 2일 오후 4시 기준 7767명(15%)이 참여했으며 오는 16일 마감한다.
삼중음성 유방암 환자의 아들이라고 자신을 밝힌 청원인 이모 씨는 "엔허투가 HER2 유방암 뿐만 아니라 HER2 저발현 유방암 환자에서도 높은 효능과 안전성을 보인다. 하지만 우리나라 처방 승인은 현재 반쪽 짜리도 되지 않는다. 국내에서 HER2 유전자가 발현되는 유방암 환자 중 15%만 이 약의 혜택을 볼 수 있고, 나머지 65%는 단순 행정 절차 지연으로 처방받지 못 하고 있다"고 적었다.
그는 "효능과 안전성에 의심이 없는 상황에서 절차적 문제로 승인이 지연되는 것이 너무 슬프다"고 호소했다. 엔허투 청원만 보더라도 허가, 급여, 적응증 확대까지 실제 국내 환자가 신약을 사용할 수 있는 기간이 빠르지 않고, 그 단계도 복잡하다는 것을 알 수 있다. 특히 암 환자와 가족들은 앞서 엔허투 청원인처럼 "절차적 문제로 승인이 지연되는 것을 이해할 수 없다"는 모습이다. 주무부처의 대국민 소통이 원활하지 않음을 알 수 있다.
지난 2월 청원이 올라온 EGFR 비소세포폐암 변이 표적치료제 타그리소 내용도 마찬가지다. 이 청원은 지난 27일까지 5만 명의 국민 참여를 달성했다.
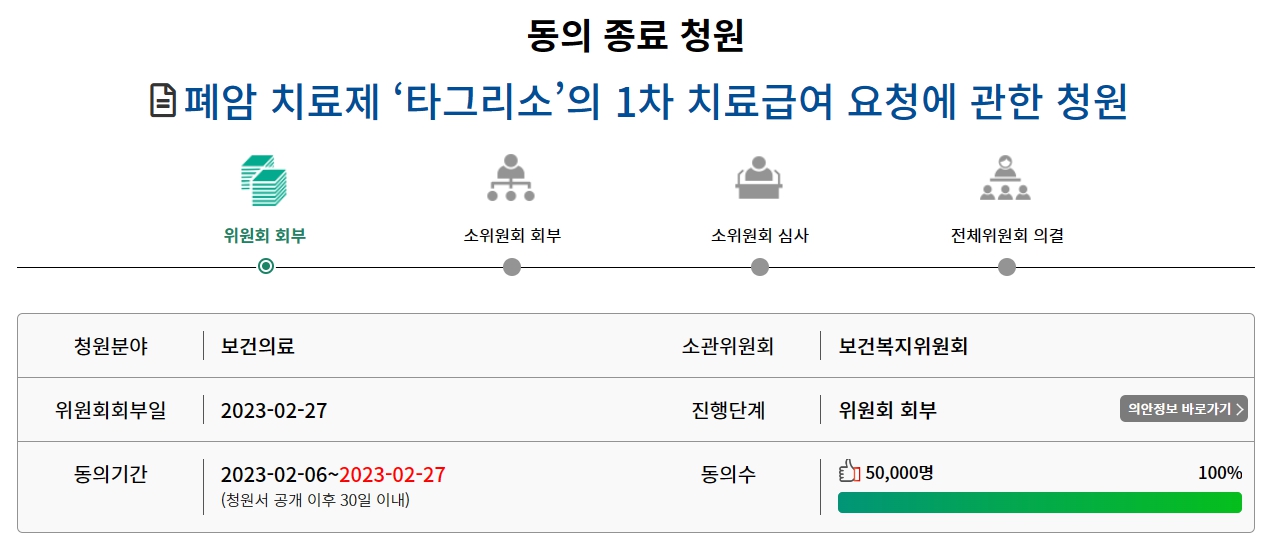
타그리소는 FLAURA 3상을 통해 비소세포폐암 표적 1차치료에서 효능을 입증했다. 1차 치료 경험이 없는 EGFR 양성 환자 대상으로 타그리소와 표준요법(게피티닙 또는 엘로티닙)을 비교해 1차평가변수인 mPFS에서 타그리소 투여군은 18.9개월(표준요법 치료군 10.2개월)을 기록했다. 2차평가변수인 mOS는 타그리소 투여군이 38.6개월(표준치료 요법 31.8 개월)이었다.
지난 2017년 폐암 2기A 진단을 받았다는 청원인 김모 씨는 수술 후 재발을 겪었고 이레사(게피티닙) 복용 후 뇌 전이가 일어나 타그리소로 치료제를 변경했다.
김모 씨는 "의사는 뇌 전이가 발견되자 선택의 여지가 없다며 타그리소 변경해 주었다. 건보 급여가 되지 않아 한 달 600만원인 약을 환자에게 쉽게 권하기 어려운 마음이 아니었을까 한다"고 적었다.
김모 씨는 "재발 진단을 받고 지푸라기라도 잡는 심정으로 타그리소를 복용했고 3개월 뒤 검사에서 모든 종양이 없어졌다는 기적 같은 소식을 들었고 현재는 암 진단을 받은 적 없는 사람처럼 건강 상태를 유지하고 있다"고 말했다.
그는 앞으로가 더욱 문제라고 했다. 고가의 투약 비용 때문이다. 김모 씨는 "눈앞에는 약값이라를 너무 높은 현실의 벽이 있다. 타그리소를 1차 치료에 사용할 경우 건보가 적용되지 않아 약값이 환자와 가족의 부담으로 돌아오기 때문이다. 1년 넘게 타그리소를 먹으며 약값으로만 7000만원을 썼다"고 밝혔다.
이어 "어떻게 약값을 마련해야 할지, 가족에게 미안하고 너무 큰 고통을 주는 것 같아 괴롭지만 약을 끊을 수도 없다. 치료비가 버거운 암 환자는 저 뿐만이 아니다. 폐암 환자들이 치료를 포기하지 않도록 타그리소 1차 치료 급여 승인을 간절히 바란다"고 호소했다.
BRAF V600E 변이가 확인된 전이성 직결장암 치료제로 허가된 비라토비도 급여에 막혀 있다. 현재 비라토비는 국내에서 앞서 치료 경험이 있으면서 BRAF V600E 변이가 확인된 직결장암 성인에서 얼비툭스(세툭시맙) 병용요법이 가능하다.

지난 2월 14일 청원을 올린 정모 씨는 "BRAF 변이에 유일한 표적치료제인 비라토비는 국내 병원에서 처방되고 있지만 심평원 약제급여평가위원회에 상정되지 못 해 한 달 처방비로 1200만원이 발생하고 있다"고 밝혔다.
정모 씨는 거듭 "2022년 1월 허가된 약이 아직까지 약평위에 상정도 되지 않았다. 저는 치료를 적극적으로 받아 조금 더 생을 이어나가고 싶다. 살고 싶지만 돈이 없어 치료를 받을 수가 없다. 제발 환자 목소리에 귀를 기울여 급여화가 될 수 있도록 도와달라"고 올렸다.
비라토비는 BEACON CRC 연구에서 1차 치료나 2차 치료 후 BRAF V600E 변이가 있는 절제 불가능한 진행성이거나 재발성인 직결장암 환자를 대상으로 얼비툭스(세툭시맙) 병용 효과를 확인했다.
연구에서 비라토비-세툭시맙 병용은 mOS 8.4개월로 이리노테칸-얼비툭스 대조군 5.4개월 대비 연장 효과를 나타냈다. mPFS는 비라토비-세툭시맙 병용 4.2개월, 이리노테칸-얼비툭스가 1.5개월이었다.
관련기사
- EGFR 18·19·21 아니라면 엑손20 검사, 리브리반트·엑스키비티 있어
- 중요한 건 꺾이지 않는 마음? 일본인 대상 1차치료 분석 공개한 타그리소
- "타그리소·렉라자 3세대 TKI 표적치료제 내성 어떻게 극복할까"
- "남은 65% 유방암 환자를 위해" 엔허투 저발현 적응증 확대에 국민 힘 모은다
- ADC가 뭐길래, 종근당도 암젠도 '유도탄' 기술 확보 나섰나
- 유방암 신약 엔허투, 최종 목적지는 'HER2 저발현'
- "이거 쉽지 않네"...해외서 잘나가던 엔허투, 왜 암질심에 발목 잡혔을까
- 전세계 '급여 최저가' 등재한다는 엔허투, 빠르면 이달 말에 암질심 논의
- 엔허투 암질심 통과, 국민적 '공감' '최저가' 적중했다
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

