기해년 새해에도 내수 부진과 약가 인하 압박, 금리 인상 등 제약업계에 전반적으로 위기설이 점쳐지고 있지만 대박을 기대하게 하는 신약 시판허가와 임상시험 결과가 줄줄이 기다리고 있어 난국을 돌파할지 주목되고 있다. 올해 중대한 고비에 서있는 대표기업인 대웅제약, 한미약품, 종근당, SK바이오팜, 바이로메드의 파이프라인을 확인해 봤다.
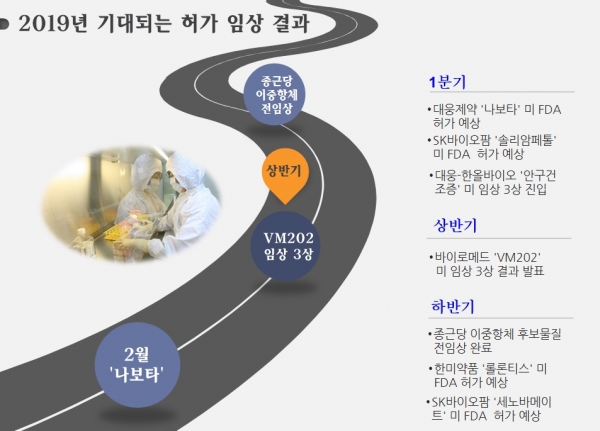
대웅제약 ‘나보타‘ 2월 美 FDA 승인 기대
안구건조증 치료제 기술 가능성 높아
우선 대웅제약의 나보타가 내달 2일 미국 FDA 허가 승인 결정으로 포문을 연다. 회사는 2017년 매출 업계 3위에서 지난해 3분기 누적 기준 5위로 내려앉았고, 여기에 직원에 대한 폭언논란까지 있었던 만큼 힘든 한해를 보냈다. 이런 가운데 대웅제약은 올해 보툴리눔톡신 '나보타'에 큰 기대를 걸고 재도약에 나선다.
나보타는 현재 FDA와 유럽의약품청(EMA)에서 동시에 허가 심사를 진행 중이다. 앞서 지난 해 8월에는 캐나다에서 판매 허가를 받았고 이미 5년간 3000억 원의 수주 계약이 체결된 상태로 국산 보툴리눔톡신 제제로는 처음으로 선진국 시장에 진출하면서 매출 급증이 예상된다.
또 추가적으로 기대되는 신약에는 한올바이오파마와 공동 개발 중인 안구건조증 치료제 ‘HL036’로 미국 임상2a를 이미 진행했고 지난해 10월 시카고 안과학회에서 긍정적 결과를 발표한 바 있다. 기존 치료제에는 엘러간의 ‘레스타시스’와 샤이어의 ‘자이드라’가 전부인 가운데 안구건조증 치료제 시장규모가 3.8조원 수준인 만큼 기술수출에 대한 기대감이 커지고 있다. 수출성사 시 대웅제약은 50%의 권리를 행사할 수 있다.
임상 3상에 돌입하는 HL036은 안구건조증 치료제를 1차 타깃 적응증으로 개발하고 있으며 회사는 향후 당뇨병성 망막증, 황반변성증으로 적응증을 확대할 계획이다.
한미약품 R&D 모멘텀 다수보유로 성장 견인 전망
바이오 신약 ‘롤론티스’ 및 폐암치료제 ‘포지오티닙’ 순항
한미약품은 작년 1분기 0.8%에 그치는 성장으로 스타트를 끊었지만 이후 꾸준한 매출 성과를 보이면서 2018년에 10% 성장을 달성할 것으로 전망되고 있다. 현재 회사는 국내 제약기업 중 최다 R&D 모멘텀을 보유 중이다.
한미약품이 보유중으로 가장 기대되는 신약에는 미국 스펙트럼사에 기술수출한 첫 바이오 신약 ‘롤론티스’와 폐암치료제 ‘포지오티닙’을 꼽을 수 있다.
지난해 혁신지료제(BTD) 지정에 실패한 포지오티닙은 올해 BTD 재신청 없이 연내 신속승인 신청을 목표로 진행할 계획이다. 올 1분기 임상 2상 환자등록을 완료하고 내년 하반기 중간 결과가 발표될 것으로 보인다. 때문에 업계에서는 2020년 신속승인을 받을 것으로 전망하고 있으며 2021년 3상이 완료되고 최종 시판허가는 2023년이 될 것으로 점쳐지고 있다.
호중구감소증 치료제 ‘롤론티스’는 4분기 FDA 허가가 기대된다. 롤론티스는 한미약품의 핵심 플랫폼 기술 ‘랩스커버리’가 적용된 첫 번째 바이오 신약으로 지난달 27일 생물의약품 허가신청을 냈고 회사는 2020년 상반기 품목 허가를 획득할 수 있을 것으로 전망하고 있다.
또 얀센에 기술 수출한 당뇨·비만치료제도 올 3월 임상 2상이 완료된 이후 4분기 중 임상 3상을 진행할 것으로 예상되며 임상 3상 진입 시 얀센으로부터 추가 마일스톤이 기대된다.
종근당 이중항체 후보물질 ‘CKD-702’ 전임상 완료 예정
전임상 단계서 기술이전 계약시 평균 3억 달러 체결
지난해 매출상위 제약사 중 가장 안정적 실적이 예상되는 종근당은 자사 최초의 바이오 신약으로 이중항체 후보물질 ‘CKD-702’에 큰 기대를 걸고 있다. 현재 미국에서 전임상을 진행하고 있으며 올 하반기 전임상이 완료될 것으로 전망된다.
회사는 CKD-702가 표적항암제에 내성을 가진 비소세포폐암 동물실험에서 우수한 항암효과를 나타냈다고 밝혔으며 폐암뿐만 아니라 위암 등 다른 고형암 치료제로의 개발 가능성도 확인했다.
주목할 점은 이중항체가 최근 면역관문억제제 및 CAR-T와 같은 면연항암제들이 크게 부각 받으면서 업계 관심이 높아지고 있다는 것. 아직까지 대부분의 이중항체는 임상 1,2상의 초기 단계로 현재 FDA나 유럽 EMA의 승인을 획득해 상용화된 제품은 3개에 불과해 성장가능성도 매우 높은 상태다.
또 이중항체 후보물질의 경우 그동안 평균적으로 전임상 단계에서 기술이전 계약이 체결됐으며 각 후보 물질 당 평균 3억 달러 규모로 체결됐다. 실제로 얀센이 마크로제닉스사의 전임상 단계 이중항체를 7.4억 달러에 도입하는 대형 계약을 체결한 바 있다.
한편 이중항체 플랫폼 기술을 보유한 제약바이오사는 한미약품, 녹십자, 파맵신, 에이비엘바이오 등이 기술을 보유하고 있으며 종근당은 올해 후보물질 전임상 완료로 기술 계약 체결 가능성을 높이고 있다.
SK바이오팜 R&D 성과로 나스닥 진출 검토
뇌전증 치료제 ‘세노바메이트’ 美 진출 시 1조 기대
SK가 100% 출자한 SK바이오팜의 미국 시장 진출이 본격화 될 것으로 전망되고 있다. 회사는 국내 제약바이오기업 중 가장 많은 16개의 신약 후보 물질을 FDA로부터 승인 받아 역량을 인정받고 있다.
특히 올해는 SK바이오팜이 미국 재즈社에 기술수출한 수면장애 치료 신약 '솔리암페톨'의 허가가 기대되고 있다. 당초 지난해 판매허가가 예상됐으나 라벨 문구 수정 등으로 인해 검토 기간이 오는 3월20일로 심사 연장됐다. 회사는 지난 2011년 JAZZ와 글로벌 임상 3상을 공동 진행하는 조건으로 솔리암페톨의 기술수출 계약을 맺었다
또 다른 기대주인 뇌전증(간질) 치료제 ‘세노바메이트’의 미국 허가도 지난해 11월 신청했다. 통상적으로 FDA의 판매 허가 절차가 10개월에서 1년가량 걸리는 것을 감안하면 연내 판매 허가가 나올 것으로 기대된다. 회사는 미국 판매 시기를 2020년으로 보고 있으며 출시가 현실화 될 경우 지난해 미국 시장에서만 약 1조원의 매출을 기록한 시장 선도 제품인 빔팻(UCB제약)에 필적하는 매출을 올릴 것으로 전망하고 있다.
SK바이오팜은 이러한 성과를 바탕으로 내년 국내 또는 미국 나스닥 상장을 검토 중이며 시장에서는 세노바메이트의 가치를 5조4100억원, 솔리암페톨의 가치를 8072억원으로 추정하고 있다.
바이로메드 미국 최초 유전자가위 임상 승인
‘VM-202’, 올 상반기 美 3상 결과 발표 기대
바이로메드의 ‘VM-202 DPN’(통증성 당뇨병선 신경병증)는 세계가 주목하는 파이프라인으로 임상 3상이 성공적으로 완료되면 혁신 DNA신약으로서 전 세계에서 의약품 판매 기대 가능성이 높아진다.
FDA는 지난해 11월 임상 1/2상 임상시험계획의 신청을 승인했는데 이는 미국에서 3세대 유전자가위(CRISPR)를 인체에 적용하는 첫 임상시험으로 기록됐다는 데 의미가 크다.
VM-202는 DNA치료제로 현재 DPN 환자와 PAD(허혈성 족부궤양) 환자대상으로 미국 3상을 진행 중이다. 특히 DPN 환자 약물투여 추적 관찰이 올 4월 마무리 예정으로 상반기 내 3상 결과가 발표 될 것으로 전망된다. 회사는 이후 장기간 지속되는 진통효과로 적응증을 넓혀간다는 계획이다
때문에 글로벌 신약 임상이 성공적으로 완료되는 2020년 전후 기업 가치는 크게 변화가 있을 전망이다. 현재 글로벌 DPN 의약품 시장은 3~4조원으로 추정되고 있으며 처방 진통제 주요제품인 화이자의 ‘리리카’가 연매출 5조원 이상 기록되는 블록버스터란 점을 감안하면 업계에서는 최소 4조원 이상의 파이프라인 가치를 예상하고 있다.
약업계 한 관계자는 “국내 제약·바이오 기업들이 그동안 R&D에 투자한 성과가 지난해부터 결실을 맺고 있는 가운데 아는 올해 기술수출과 제품출시로 이어지면서 신약개발의 이정표가 되는 한해가 될 것”이라고 전망했다.
키워드
#기술수출 #라이선스아웃 #한미약품 #종근당 #대웅제약 #SK바이오팜 #바이로메드 #바이오 #신약 #주식 #나스닥 #코스닥 #코스피 #롤론티스 #포지오티닙 #CKD-702 #세노바메이트 #VM-202 #나보타개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

