유한양행이 신약 렉라자(성분명 레이저티닙메실산염)에 대한 식품의약품안전처의 조건부 허가를 받아내면서 올해 첫 단추를 순조롭게 끼우는 데 성공했다. 유한양행 측은 앞으로 레이저티닙 외에도 다양한 R&D 파이프라인을 통해 신약 개발을 궤도 위로 끌어올리겠다는 계획이다.
유한양행은 18일 자사가 개발 중인 비소세포폐암 치료제 렉라자정이 상피세포 성장인자 수용(Epidermal Growth Factor Receptor, 이하 EGFR) T790M 돌연변이 양성 비소세포폐암 적응증에 대한 조건부 허가를 받았다고 밝혔다. 렉라자는 1997년 선플라 이후 31번째 국내 개발 신약으로 이름으로 올렸다.
렉라자정은 EGFR에 발생한 T790M 돌연변이 내성에 특화된 3세대 표적치료제다. T920M 돌연변이란 EGFR 내 단백질의 특정 위치에 있는 아미노산 1개가 트레오신에서 메티오닌으로 바뀐 돌연변이로, 기존 1·2세대 EGFR 표적치료제에 내성을 가진다.
렉라자는 특히 폐암 세포 성장에 관여하는 신호 전달체 ‘티로신키나아제’를 선택적으로 억제해 폐암세포의 증식과 성장을 막는다. 또한 뇌혈관장벽(BBB) 통과가 가능해 뇌 전이가 발생한 폐암 환자에게도 유효한 약성을 보인다.
식약처는 렉라자의 치료 효과가 뛰어나다는 점을 고려해 3상 임상시험이 완료되지 않았지만 조건부 허가를 승인했다. 정확한 효능·효과는 이전에 EGFR 표적치료제로 치료받은 적이 있는 T790M 변이 양성 국소 진행성 또는 전이성 비소세포폐암 환자의 치료다. 돌연변이로 인해 1·2세대 표적치료제에 내성이 생겨 치료가 어려운 환자들을 대상으로 한다는 뜻이다.
유한양행은 그동안 꾸준히 렉라자 관련 연구 성과를 학계에 공개해왔다. 유한양행은 렉라자의 안전성에 대한 결과를 국제학술지 ‘랜싯 종양학(The Lancet Oncology)’ 2019년 10월자에, 효능에 대한 결과는 2개 논문을 통해 미국임상종양학회(ASCO)이 발행하는 국제학술지 ‘임상 종양학 저널(Journal of Clinical Oncology) 2020년 5월 25일자에 각각 발표했다.
랜싯 종양학에 발표한 논문에 따르면 임상에 참가한 127명의 환자 중 보고된 일반적인 부작용으로는 여드름(30%)과 가려움증(27%) 등이 있었다. 3등급 이상의 부작용은 16%, 그중에서도 렉라자 투여와 관련성을 배제할 수 없는 부작용은 3% 수준으로 낮게 나타났다.
임상종양학 저널에 발표한 논문들에 따르면 T950M 돌연변이 환자에게 렉라자 240mg을 투여할 경우, 종양이 30% 이상 줄어드는 객관적 반응률(ORR)은 57.9%, 종양이 20% 이상 증가하지 않은 질병 조절률(DCR)은 89.5%로 나타났다. 무진행생존기간(PFS)의 중간값은 11개월로 나타났다.
뇌 전이가 발견된 비소세포폐암 환자 64명의 경우 두개강 내 질병조절률(IDCR)은 90.6%를 기록하면서 90% 이상의 환자들이 종양 악화가 느려지거나 감소한 것으로 나타났다. 특히 측정 가능한 뇌병변이 있는 22명의 경우 IDCR은 90.8% 두개강 내 ORR은 54.5%로 나타났다. 22명 중 절반 이상의 종양이 30% 이상 감소한 것.
현재 렉라자는 이같은 결과에 힘입어 글로벌 임상3상 단계로 들어선 상황이다. 2019년 12월부터 진행 중인 국내 임상3상과 함께 현재 17개국에서 임상3상을 진행 중이다. 특히 지난해 10월 19일에는 글로벌 제약사 얀센이 자체 개발 중인 항체치료제 아미반타맙과 레이저티닙(렉라자)의 병용요법에 대한 임상 모집을 시작했다고 미국 국립보건원(NIH) 임상시험등록사이트 클리니컬트라이얼즈(clinicaltrials.gov)을 통해 발표하기도 했다.
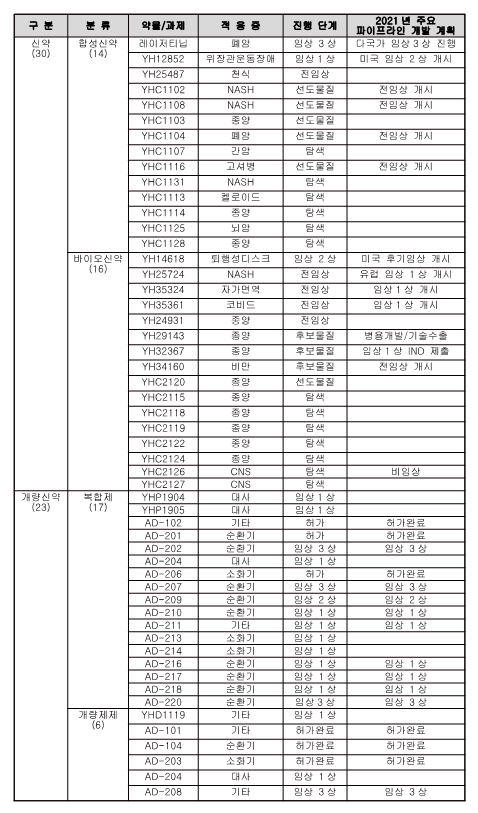
한편 유한양행은 렉라자를 포함한 다양한 신약 연구를 통해, 신약 개발 시장 내 입지를 확보하겠다는 계획이다. 지난해 12월 31일 기준 유한양행(자회사 애드파마 등 포함)이 가동 중인 R&D 파이프라인은 신약 30종과 개량신약 23종이다.
신약의 경우 합성신약이 총 14종, 바이오신약이 총 16종이다. 이중 임상시험 단계에 돌입한 신약은 렉라자를 비롯해 YH12852, YH14618 등 총 3종이다.
YH12852의 경우 소화기 관련 합성신약으로 수술 후 장폐색증에 효과를 보인다. 현재 임상1상 단계로 올해 내 미국 임상2상을 개시할 계획이다. YH14618은 퇴행성 디스크 관련 바이오신약으로 현재 임상2상을 진행 중이다. 올해 내로 미국 후기임상을 개시할 예정이다.
임상 전 단계인 전임상을 진행 중인 신약은 총 5종으로, 합성신약 1종(YH25487)과 바이오신약 4종(YH25724, YH35324, YH35361, YH24931) 등이다. 이들 중 비알코올성지방간염(NASH) 치료제인 YH25724와 자가면역 치료제인 YH35324, 코로나19 항체치료제인 YH35361은 올해 내로 임상1상을 개시한다는 계획이다.
특히 YH35361의 경우 현재까지 보고된 돌연변이 타입에 모두 대응 가능한 중화항체 치료제로, 2021년 1분기 내 임상1상 개시를 목표로 하고 있다.
관련기사
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

