최근 5년간 임상3상을 조건부 허가한 의약품 32건 중 8개 제품이 실제 생산으로 이어지지 않았던 사실이 확인돼 제도 효용성에 대한 논란이 커질 전망이다.
국회 보건복지위원회 소속 백종헌 국민의힘 의원이 13일 식품의약품안전처로부터 제출받은 자료에 따르면 최근 5년간 임상3상이 조건부 허가된 32건 등 8개(25%)가 생산실적이 전혀 없는 것으로 나타났다.
임상3상 조건부허가는 생명을 위협하는 질병이나 현존하는 치료법으로는 치료가 불가능한 경우(항암제, 희귀의약품 등) 환자들에게 신속한 치료기회의 제공을 목적으로 하는 제도다.
세부적으로 살펴보면, 최근 5년간 식약처에 3상 조건부허가를 신청한 건수는 총 34건으로 이중 32건(94.1%)가 허가를 받았다.
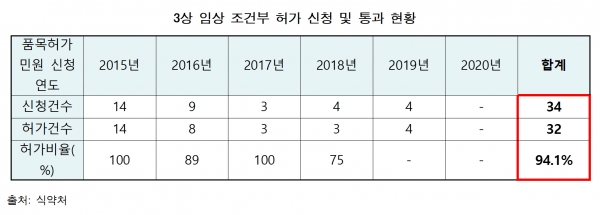
하지만 조건부허가를 받은 중 4분의 1에 달하는 8개 제품은 현재 시점에서 생산실적이 전혀 없는 것으로 드러났다. 이들 중 1개 의약품은 허가 이후 생산이 전혀 이뤄지지 않았고, 2020년 현재 시점에서 생산이 이뤄지지 않는 제품은 5개였다. 생산이 전혀 없었고 자진취소를 해버린 제품도 2건에 달했다.
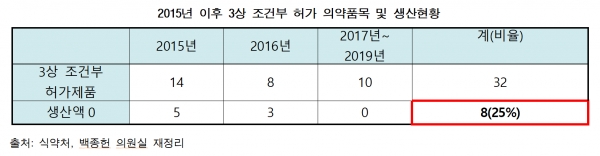
또 해당 제도가 국산신약 개발을 독려하기 위해 마련됐는데도, 조건부 품목 32개 중 국산신약이 단 3개(9.4%)로 10%에도 미치지 못하는 것으로 확인됐다.
백 의원은 “현재 3상 조건부허가와 관련된 가이드라인이 있지만, 이런 논란이 지속해서 일어나고 있어 상위법령을 개정할 필요가 있다”며 “임상시험 관련 허가조건 부관 의약품의 관리업무와 관련된 상세 관리방안을 개정해 근본적인 문제를 해결해야 한다”고 밝혔다.
이어 “3상 조건부허가에 대한 지속적인 논란을 종결하기 위해 허가신청 단계부터 조건부 허가 대상 및 조건이행 제출일자를 명확히 할 필요가 있다”며 “업체의 조건이행력 확보를 위해 행정처분 규정 세분화, 실태조사 및 감시체계를 확립하는 내용의 법 개정도 필요하다”고 덧붙였다.
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

