
최근 정부의 약가인하(4월 시행 예정)와 한미FTA 발효 등은 제약산업의 환경 생태계에 위협요인으로 작용하고 있다. 이 같은 위협요인으로 작용될 수 있는 제약업계의 다양한 환경변화는 국내 제약사로 하여금 도전과 혁신을 요구하고 있다.
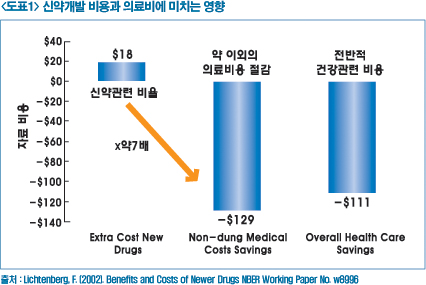
제약산업이 미래 가치를 인정받고, 타 산업과 차별화되어 고부가가치를 창출하는 방법은 신약개발일 것이다. 신약은 의료비용 절감 효과가 높은 것으로 최근의 새로운 고가 신약의 도입에 따라 의료비가 상승한다는 편견도 있다. 그러나 이는 하나의 약물에 소요되는 비용을 고려했을 뿐 전반적인 의료비와 연계한다면 국내와 같이 인구 고령화에 따라 의료비 부담을 절감하기 위한 대안으로 판단된다.
국내 제약산업의 신약개발은 미국이나 일본에 비해 역사가 짧은 후발주자로 전 세계로 통할 수 있는 혁신적인 신약을 개발하기에는 경험과 투자 재원의 확보가 어려운 것이 현실이다.
그러나 우리나라의 제약산업은 그간 제너릭 의약품중심의 산업에서 신약개발을 위한 혁신의 노력으로 기업이 진화하고 있다.
국내 신약개발의 역사는 1987년 7월에 개정된 물질특허제도 도입 이래로 18개의 신약과 더불어 국산신약 중 동아제약의 스틸렌의 경우, 국내 처방의약품 2위 품목(연간 약 900억원)을 달성하여 국산 신약의 가능성을 엿볼 수 있다.
이와 같은 노력들은 우리나라 제약기업들이 제네릭 의약품을 중심으로 리베이트의 오명을 받고 있지만 일각에서는 신약개발의 혁신을 하고 있다는 반증일 것이다.
신약개발은 전 세계적으로 연구개발의 생산성의 감소, 허가기준의 강화, 건강보험 재정의 영향, 신약 라이프사이클의 축소, 임상시험의 실패가 확대되고 있어 글로벌 진출을 위한 신약개발 효율화 전략을 고민해야 한다.
이는 국산신약이 국내의 굴레를 벗어 세계로 진출하기 위해서는 세계속에서 냉철한 현실을 인식하고 전략적인 접근이 필요할 것이다.
신약개발의 글로벌 환경변화
신약개발은 국내 출시의 목표가 아닌 세계시장을 목표로 해야 한다. 이로 인해 향후 제약시장의 환경을 진단하고 이를 통해 정확한 전략 목표를 설정해야 할 것이다.
글로벌 시장에서 제약기업의 성장에 부정적인 영향을 미치는 요인들로 선진국은 물론 이머징마켓(Emerging market) 조차도 의약품의 가격과 보험급여를 지속적으로 인하하고 있고, 의약품의 안전성을 확보하기 위해 보다 강도 높은 규제를 적용하고 있다.
특히, 세계에서 의약품 시장이 가장 큰 미국은 최근 의료개혁을 통해 중장기적으로는 새로운 보험체계에서 매출규모를 확대할 수 있는 긍정적인 요인으로 작용할 수 있다. 그러나 단기적으로 Medicare Part D(소위 Donut hole, 처방의약품 비급여)를 폐지하면서 오리지널 의약품 구매 시 50%를 할인해야 하고, 보험재정에 리베이트를 연간 28억달러에서 40억달러를 기부해야하는 등 향후 10년간 280억달러를 부담해야 하는 등 기업입장에서 부정적인 요인으로 작용하고 있다.
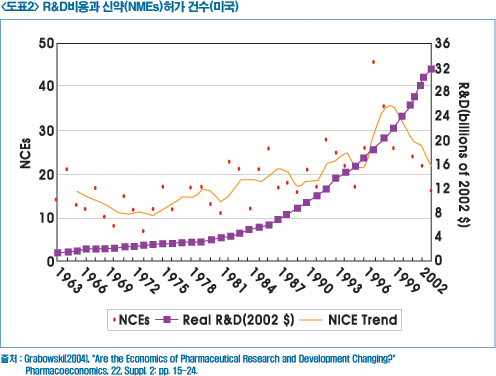
미국 제약협회(US PhRMA)에 따르면 미국에서 전체 제약회사의 R&D비용은 2005년에 비해 34억달러 증가돼 2006년에는 552억달러가 소요됐음에도 불구하고, 미국 FDA에서 승인된 신규화합물 신약(NMEs, New Molecular Entities)의 수는 지속적으로 감소하고 있다.
이와 같은 원인들은 신약개발에 확신을 담보할 수 없는 새로운 기술들을 응용하거나, 허가기준이 좀 더 강화되고 복잡해졌기 때문이라고 파악된다.
최근 신약개발의 R&D와 라이센싱 동향
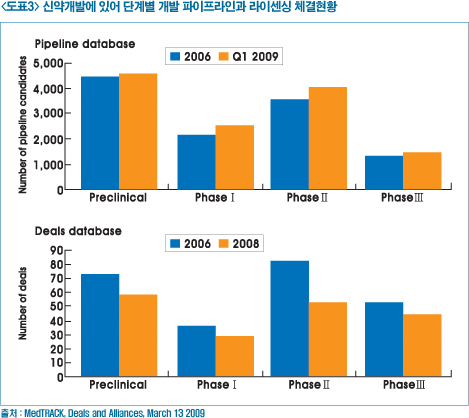
최근 신약개발과 라이센싱 트렌드에 있어 과거 후기 단계(후기 임상 등)에서 초기단계(후보 물질 도출, 비임상 등)로 넘어가 있고, 실제로 신약후보물질 임상 III상은 임상 II상 개발 건수에 비해 47%(2000년)이었으나 35%(2008년) 감소한 반면 신약후보 물질 중 비임상과 임상 II상단계 물질들이 가장 많은 라이센싱 활동이 발생하고 있다.
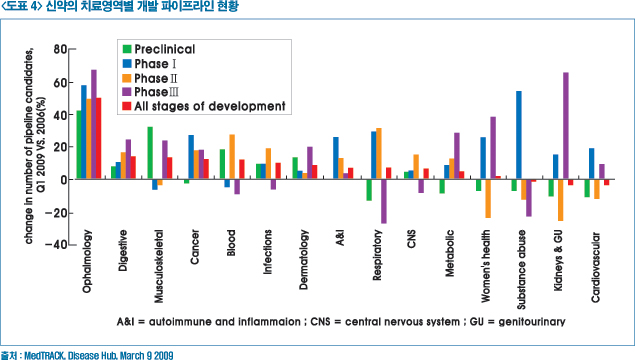
또한, 질환 중심의 거대 시장에서 틈새시장(Niche market)으로 기전(Mechanism)을 규명하는 신약개발의 전략이 이동하고 있다. 지난 2006년~2009년 동안 신약의 치료영역별 파이프라인은 평균 9.4%로 증가됐고 그중 안과질환과 같이 희귀질환들은 확대되고 있는 반면 심혈관질환 파이프라인은 감소추세이다.
이와 같은 신약개발의 트렌드는 메가 트렌드와 연계되고 있다. 과거의 원인이나 기전을 알지 못했던 것이 휴먼 게놈프로젝트 등 과학기술의 발달로 인해 질병의 원인이 되고 있는 기전이 알려지면서 선택적 신약개발을 통해 효율화를 모색하고 있다.
신약개발 전략과 나아가야 할 방향
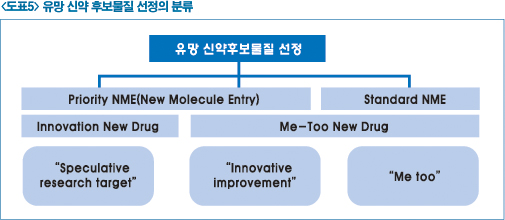
▶ 유망 신약 후보물질 선정 전략
유망한 신약 후보물질을 선정하는 것은 신약을 개발하는 기업입장에서는 매우 중요한 선택이다. 왜냐하면 1만분의 1의 확률과 10년에서 15년 동안 신약개발에 투여되는 시간과 비용을 고려했을 때 적절한 신약개발 후보의 발굴이야말로 실패율을 줄이고 성공으로 이어질 수 있기 때문이다.
유망한 신약후보 물질의 선정은 이미 알려져 있지 않는 작용기전을 활용해 새로운 분자화합물과 이미 알려져 있는 작용기전을 응용해 공지된 분자화합물을 응용해 고려할 수 있다. 새로운 기전 등 혁신성을 갖는 신약 후보물질은 리스크는 높으나 향후 고부가가치를 창출할 수 있는 중요한 기회를 제공받을 수 있는 것이다.
지금까지 한국의 국산신약을 비롯해 미국 FDA에서 승인된 약 2/3가 ‘Me Too’ 신약들이다. 리스크는 덜하지만 고부가기치를 창출하기에는 한계점에 도달하고 있으며 신약개발의 생산성 저하의 어려움을 극복하는데 장애요인으로 지적되고 있다.
따라서 이와 같이 유망 신약 후보 물질 선정에 있어 차별화된 전략과 노력이 수반돼야 한다. 리스크는 크지만 새로운 기작을 갖는 혁신적인 신약개발이 향후에도 중요시 될 수 있다. 다만, 리스크가 덜한 신약후보 물질이더라도 새로운 전략과 전술이 필요하다.
▶ 신약개발 R&D 비용 절감을 위한 전략
신약개발의 생산성 저하에 따른 R&D 비용 절감을 위해 유럽제약 연구협회(EFPIA, European Federation of Pharmaceutical Industries and Associations)는 신약이 출시되기 위해서는 총 1.3억달러가 소요되는 것으로 보고하고 있다. 이들 협회는 이와 같은 막대한 신약개발의 자금을 효율적으로 활용하기 위해 단계별 비용절감을 제안하고 있다.
후보물질 및 비임상단계에서 0.35억달러가 소요되는데 라이센싱 전략을 통해 외부의 파이프라인을 활용해 비용을 절감해야 한다. 비용이 0.64억달러로 신약개발에 가장 많이 소요되는 임상단계에서는 환자선택에 있어 바이오마커(Biomaker)를 활용해 좀 더 선택적으로 구성해 임상비용을 줄여야 한다고 지적하고 있다. 그러나 허가단계는 PMS를 포함해 0.21억달러가 소요되나 비용을 줄일 수 있는 어려움이 있다고 주장하고 있다.
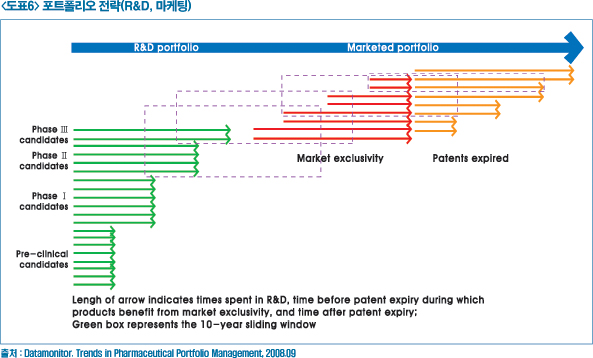
▶ 신약개발 포트폴리오 전략
신약개발의 포트폴리오 전략(Portfolio management)은 앞서 언급했듯이 R&D 생산성의 감소와 규제당국의 강도 높은 규제의 강화, 이로 인해 의약품이 시장에서 판매되는 생존주기가 짧아지고 있다. 또 선진국을 포함하여 파머징(Pharmerging) 마켓조차도 의약품이 가격 인하되고 보험 급여의 범위가 비용 효과성을 강조해 인정범위가 낮아지고 있어 이에 대한 제약기업의 혁신의 노력의 일환으로 모색되고 있다.
신약개발의 포트폴리오 전략은 맞춤형으로 환자를 대상으로 하거나, 더 많은 환자, 보험자(Payers), 의사(Physician)를 확보하기 위한 전략을 집중화 할 수 있을 것이다. 이를 위해 개발 초기부터 R&D부문과 마케팅 부문의 연계를 통해 최근의 환경변화의 어려움을 극복하기 위한 전략적 대안으로 부각될 수 있다.
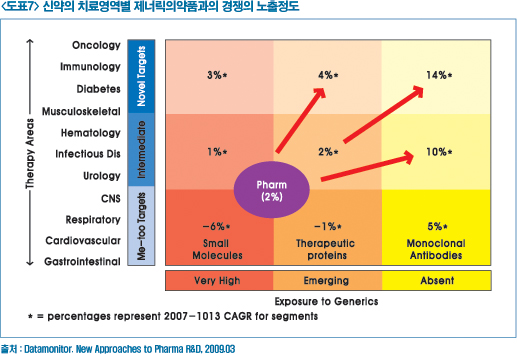
▶ 신약개발의 희귀질환과 틈새시장
블록버스터 의약품의 개념도 재정립되고 있다. 전통적으로 블록버스터 의약품은 환자 백만명이 연간 천달러의 의약품비 지출이 되고 있는 의약품을 지칭했었다.
그러나 최근에는 니치 질환의 경우, 환자 십만명이 연간 만달러, 희귀질환 의약품이 환자 만 명이 연간 십만달러, 울트라 희귀의약품(Ultra-orphan drug)이 환자 5,000명이 연간 이십만달러의 의약품비를 지출하는 의약품으로 동일한 경제적 효과를 갖는 블록버스터 의약품으로 분류되고 있다.
전통적으로 환자가 많은 주질환을 목표하는 것과 희귀질환과 같이 니치질환을 목표로 신약개발은 장단점이 있다. 이에 대해서는 개발 기업들이 전략적인 판단에 의해 접근할 사안이나 국내 신약개발의 역사와 세계적인 위치에서 신약개발의 효율화와 차별화를 위해서는 니치 질환을 목표로 경쟁이 덜 치열한 분야를 우선적으로 공략하는 방법도 좋은 대안으로 판단된다.
희귀 의약품 개발은 바이오마커의 개발과 연계해 기전을 규명하고 이를 통해 ‘Best in Class’ 아닌 ‘First in Class’의 접근방식으로 이어질 수 있다. 실제로 미국의 FDA승인된 희귀질환의약품들 중에는 동시에 바이오마커로써 응용하고 있다.

결 론
신약개발은 제약기업의 가장 중요한 미션이며 경제활동의 근간이 될 수 있다. 최근 국내에서 대규모 약가인하 등 그간 제너릭 위주의 제약산업은 한계에 도달했고, 향후에는 신약개발의 글로벌화와 수출전략만이 이와 같은 새로운 국면을 극복할 수 있는 대안으로 판단된다.
특히, 희귀 의약품 분야의 신약개발은 세계 속에서 국내 제약기업의 새로운 가능성과 돌파구라고 판단된다. 희귀 의약품 개발을 통해 사회 안전망을 구축하고, 신약개발의 대안으로 발전하기 위해서는 제도적이고 국가적인 정책 배려가 필요해 보인다.
선진국을 중심으로 희귀의약품은 다양한 측면에서 연구개발 정책을 지원하고 있다. 미국은 희귀의약품 신약 허가시 특허와는 별도로 7년의 자료독점권을 보호해 주고 있으며 NIH 연구개발 지원프로그램을 통해서 임상 3상까지 지원해 주고 있다.
국내에서 희귀질환을 목표로 하는 신약개발의 활성화를 지원하기 위해서는 사회안전망 확충 자금 중 일부를 연구개발비에 지원할 수 있도록 연구개발비의 자금지원과 자료독점권 등 제도적인 배려가 뒷받침되어야 한다고 판단된다.
팜뉴스
다른기사 보기
개의 댓글
댓글 정렬
BEST댓글
BEST 댓글
답글과 추천수를 합산하여 자동으로 노출됩니다.
댓글삭제
삭제한 댓글은 다시 복구할 수 없습니다.
그래도 삭제하시겠습니까?
그래도 삭제하시겠습니까?
댓글수정
댓글 수정은 작성 후 1분내에만 가능합니다.

